Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
nOH- = 1,5.0,5 = 0,75 mol
nAl3+ = 0,2 mol
nAl(OH)3 = 4nAl3+ - nNaOH = 4.0,2 – 0,75 = 0,05 mol
=>mAl(OH)3 = 0,05.78 = 3,9 gam

Đáp án C
nOH- = 1,5.0,5 = 0,75 mol
nAl3+ = 0,2 mol
nAl(OH)3 = 4nAl3+ - nNaOH = 4.0,2 – 0,75 = 0,05 mol
=>mAl(OH)3 = 0,05.78 = 3,9 gam

Chọn đáp án C
● Gọi số mol NaOH dùng ở lần 1 là a mol ta có sơ đồ.
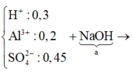
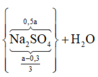
● ⇒ Với nNaOH = (a + 0,45) mol thì nAl(OH)3 = a - 0 , 3 6
+ Ta có sơ đồ:

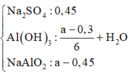
⇒ Ta có nAl(OH)3 = 4nAl(OH)3 – (nNaOH – nH+)
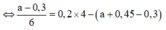
a = 0,6 mol ⇒ VNaOH = 0,6 lít = 600 ml ⇒ Chọn C

Đáp án A.
nAl(OH)3= 7 , 8 78 = 0 , 1
2NaOH + H2SO4 à Na2SO4 + 2H2O (1)
0,2 ß 0,1
Để NaOH phản ứng nhiều nhất thu được 0,1 mol kết tủa Al(OH)3 thì Al2(SO4)3 phải phản ứng hết tạo kết tủa tối đa, sau đó kết tủa tan một phần sao cho lượng kết tủa cuối cùng thu được bằng 0,1 mol.
6NaOH + Al2(SO4)3 à 3Na2SO4 + 2Al(OH)3 (2)
0,6 ß 0,1 à 0,2
NaOH + Al(OH)3 à NaAlO2 + 2H2O (3)
0,1 ß 0,1
Từ (1), (2) và (3) ta có:
nNaOH pư = 0,6 + 0,1 + 0,2 = 0,9 mol
è → Vdd NaOH = 0,9 : 2 = 0,45 M

Đáp án D
V có giá trị lớn nhất vậy có các phương trình

Vậy nNaOH = 0,9 ⇒ V = 0,45

Đáp án B
Gọi số mol MgSO4 và Al2(SO4)3 lần lượt là x và y (mol) có trong 200ml dung dịch.
+ 400 ml dd X + NH3 dư => kết tủa thu được là Mg(OH)2 : 2x ( mol) và Al(OH)3: 4y (mol)
=> ∑ mkết tủa = 58.2x + 78.4y = 65,36 (1)
+ 200 ml dd X + Ba(OH)2 dư => kết tủa thu được là Mg(OH)2 : x (mol) và BaSO4 : x + 3y (mol) ( Vì Al(OH)3 tan được trong dd Ba(OH)2 dư)
=> ∑ mkết tủa = 58x + (x + 3y).233 = 151,41 (2)
Từ (1) và (2) => x = 0,16 ; y = 0,15
+ 500 ml dd X ( có 0,4 mol Mg2+, 0,75 mol Al3+) + NaOH→ 70gam kết tủa => lượng NaOH lớn nhất ứng với trường hợp tạo Mg(OH)2↓ và Al(OH)3↓ sau đó kết tủa bị hòa tan 1 phần
=> nAl(OH)3 = (70 – 0,4.58)/78 = 0,6 (mol)
Mg2+ + 2OH → 2Mg(OH)2↓
0,4 → 0,8 (mol)
Al3+ + 3OH-→ Al(OH)3↓
0,75→2,25 → 0,75 (mol)
Al(OH)3+ OH- → AlO2- + 2H2O
(0,75-0,6) → 0,15 (mol)
∑ nOH-= 0,8 + 2,25 + 0,15 = 3,2 (mol) =nNaOH
=> mNaOH = 3,2.40 = 128 (g)

Giải thích:
nOH = 0,03 mol và nAl3+ = 0,02mol
Khi cho dung dịch NaOH vào thì
Al3+ + 3OH- → Al(OH)3
Ban đầu : 0,02 mol 0,03 mol
Sau PƯ 0,01 0 0,01 mol
→ mAl(OH)3 = 0,78 g
Đáp án D

Ta có:
\(\left\{{}\begin{matrix}n_{NaOH}=\frac{300.8\%}{40}=0,6\left(mol\right)\\n_{Al2\left(SO4\right)3}=0,15.1=0,15\left(mol\right)\end{matrix}\right.\)
\(PTHH:Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\)
Ban đầu:___0,15_______0,6____________
Phứng :____0,1_________0,6_________0,2_______
Sau : ______0,05________0_________0,2____________
\(\Rightarrow m_{Al\left(OH\right)3}=0,2.78=15,6\left(g\right)\)
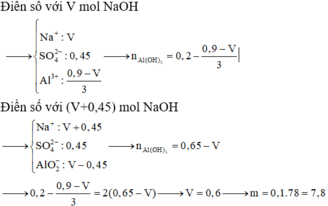
Giải thích:
nOH- = 1,5.0,5 = 0,75 mol
nAl3+ = 0,2 mol
nAl(OH)3 = 4nAl3+ - nNaOH = 4.0,2 – 0,75 = 0,05 mol
=>mAl(OH)3 = 0,05.78 = 3,9 gam
Đáp án C