Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trích mẫu thử
Cho dung dịch $Ba(OH)_2$ vào :
- mẫu thử tạo khí mùi khai là $NH_4Cl$
$2NH_4Cl + Ba(OH)_2 \to 2NH_3 + BaCl_2 + 2H_2O$
- mẫu thử tạo khí mùi khai và kết tủa trắng là $(NH_4)_2SO_4$
$(NH_4)_2SO_4 + Ba(OH)_2 \to BaSO_4 + 2NH_3 + 2H_2O$
- mẫu thử tạo kết tủa trắng là $Na_2SO_4$
$Ba(OH)_2 + Na_2SO_4 \to BaSO_4 + 2NaOH$
- mẫu thử không hiện tượng là $NH_3$

- Dùng quỳ tím
+) Hóa đỏ: HCl và AgNO3 (Nhóm 1)
+) Hóa xanh: K3PO4
+) Không đổi màu: NaNO3 và (NH4)2CO3
- Đổ dd BaCl2 vào từng nhóm
+) Xuất hiện kết tủa: AgNO3 (Nhóm 1) và (NH4)2CO3 (Nhóm 2)
PT: \(Ag^++Cl^-\rightarrow AgCl\downarrow\)
\(Ba^{2+}+CO_3^{2-}\rightarrow BaCO_3\downarrow\)
+) Không hiện tượng: HCl (Nhóm 1) và NaNO3 (Nhóm 2)

Cho quỳ tím vào từng ống: ống màu xanh là dung dịch NH3; hai ống có màu hồng là NH4Cl và (NH4)2SO4; ống không có hiện tượng gì là Na2SO4.
Cho Ba(OH)2 vào hai ống làm hồng quỳ tím. Nếu thấy ống nào có khí bay ra mùi khai là NH4Cl, ống vừa có khí bay ra mùi khai vừa có kết tủa là (NH4)2SO4.
(NH4)2SO4 + Ba(OH)2 → BaSO4 ↓ + 2NH3 ↑ + 2H2O
2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3 + 2H2O

- Lấy một phần mỗi dung dịch vào từng ống nghiệm, rồi nhỏ dung dịch HCl vào. Ở ống nghiệm có khí thoát ra là ống đựng dung dịch N a 2 C O 3 .
![]()
- Phân biệt dung dịch H 3 P O 4 , B a C l 2 , ( N H 4 ) 2 S O 4 bằng cách cho N a 2 C O 3 tác dụng với từng dung dịch: dung dịch nào khi phản ứng cho khí thoát ra là H3PO4, dung dịch nào khi phản ứng có kết tủa trắng xuất hiện là B a C l 2 , dung dịch nào khi phản ứng không có hiện tượng gì là ( N H 4 ) 2 S O 4 :
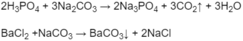

Trích các mẫu thử rồi đánh dấu.
- Cho quỳ tím vào các mẫu thử:
Mẫu thử làm quỳ tím hóa đỏ là \(\left(NH_4\right)_2SO_4,Fe_2\left(SO_4\right)_3\).
Mẫu thử làm quỳ tím hóa xanh là \(Na_2CO_3,Ba\left(OH\right)_2\).
Mẫu thử không làm đổi màu quỳ tím là \(KNO_3,NaCl\).
- Cho dung dịch NaOH dư vào hai mẫu thử \(\left(NH_4\right)_2SO_4,Fe_2\left(SO_4\right)_3\).
Mẫu thử phản ứng xuất hiện kết tủa nâu đỏ là \(Fe_2\left(SO_4\right)_3\).
Mẫu thử có khí mùi khai thoát ra là \(\left(NH_4\right)_2SO_4\).
PTHH:
\(Fe_2\left(SO_4\right)_3+6NaOH\rightarrow2Fe\left(OH\right)_3\downarrow+3Na_2SO_4\)
\(\left(NH_4\right)_2SO_4+2NaOH\rightarrow2NH_3\uparrow+Na_2SO_4+2H_2O\)
- Cho dung dịch \(H_2SO_4\) loãng dư vào hai mẫu thử \(Na_2CO_3,Ba\left(OH\right)_2\).
Mẫu thử làm xuất hiện kết tủa trắng là \(Ba\left(OH\right)_2\).
Mẫu thử làm xuất hiện khí thoát ra là \(Na_2CO_3\).
PTHH:
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
\(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2\uparrow+H_2O\)
- Cho dung dịch \(AgNO_3\) dư vào hai mẫu thử \(KNO_3,NaCl\).
Mẫu thử làm xuất hiện kết tủa trắng là \(NaCl\).
Mẫu thử không xảy hiện tượng là \(KNO_3\).
PTHH:
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)

| NaCl | Na3PO4 | HNO3 | |
| quỳ tím | không đổi màu | không đổi màu | đỏ |
| AgNO3 | kết tủa trắng AgCl | kết tủa vàng Ag3PO4 | đã nhận biết |
AgNO3 + NaCl -> AgCl + NaNO3
3AgNO3 + Na3PO4 -> Ag3PO4 + 3NaNO3
- Thử với lượng nhỏ mỗi chất.
- Bảng nhận biết:
| dd NaCl | dd Na3PO4 | dd HNO3 | |
| dd AgNO3 | Kết tủa trắng | Kết tủa vàng | Không hiện tượng |
\(AgNO_3+NaCl\rightarrow AgCl\downarrow\left(trắng\right)+NaNO_3\\ 3AgNO_3+Na_3PO_4\rightarrow Ag_3PO_4\downarrow\left(vàng\right)+3NaNO_3\)

Nhận biết được dung dịch F e C l 3 do có màu vàng, các dung dịch còn lại đều không màu.
- Nhỏ dung dịch F e C l 3 vào từng dung dịch trong ống nghiêm riêng. Nhận ra được dung dịch A g N O 3 do xuất hiện kết tủa trắng AgCl và nhận ra được dung dịch KOH do tạo thành kết tủa F e ( O H ) 3 màu nâu đỏ :
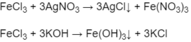
- Nhỏ từ từ dung dịch KOH vừa nhận biết được cho đến dư vào từng dung dịch còn lại là A l ( N O 3 ) 3 và N H 4 N O 3 :
Ở dung dịch nào xuất hiện kết tủa keo màu trắng, sau đó kết tủa keo tan khi thêm dung dịch KOH, dung dịch đó là A l ( N O 3 ) 3 :
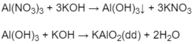
Ở dung dịch nào có khí mùi khai bay ra khi đun nóng nhẹ, dung dịch đó là N H 4 N O 3 :
N H 4 N O 3 + KOH → t ° K N O 3 + N H 3 ↑ + H 2 O (mùi khai)

Dùng dung dịch phenolphtalein nhận ra dung dịch KOH.
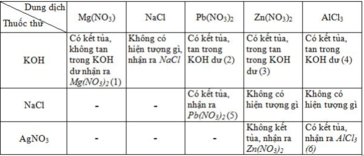
Các phương trình hoá học :
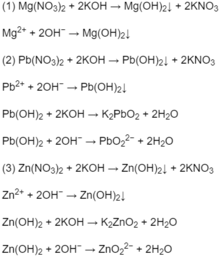
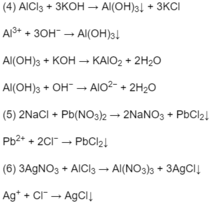
Lấy mẫu thử đánh vào 3 lọ
dùng Ba để nhận biết ta thấy : \(\left(NH_4\right)_2SO_4\) vừa tạo khí không màu mùi xốc, khai vừa tạo kết tủa trắng ; \(K_2SO_4\) tạo kết tủa trắng, còn \(NH_4NO_3\) tạo khí không màu mùi xốc, khai
PTHH: \(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
\(Ba\left(OH\right)_2+\left(NH_4\right)_2SO_4\rightarrow BaSO_4+2NH_3+2H_2O\)
\(Ba\left(OH\right)_2+K_2SO_4\rightarrow2KOH+BASO_4\)
\(Ba\left(OH\right)_2+2NH_4NO_3\rightarrow Ba\left(NO_3\right)_2+2NH_3+2H_2O\)
-Cho vào Ba
Ba+2H2O--->Ba(OH)2+H2
+ xuất hiệm khí mùi khai là NH4NO3
Ba(OH)2+2NH4NO3----> Ba(NO3)2+2NH3+2H2O
+ Có kết tủa trắng là K2SO4
K2SO4+Ba(OH)2---->2KOH+BaSO4
+Xuất hiện kết tủa trắng và khí mùi khai là (NH4)SO4
(NH4)SO4+Ba(OH)2----> BaSO4+H2O+2NH3