Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) mOxi = moxit - mkim loại = 24 - 19,2 =4,8g
nO2 = 4,8 : 32 = 0,15 mol
VO2 = 0,15.22,4 = 3,36 lít
b) pt: 2R + O2 \(\rightarrow\) 2RO
\(\dfrac{19,2}{R}\) \(\dfrac{24}{R+16}\)
=> \(\dfrac{19,2}{R}=\dfrac{24}{R+16}\)
\(\Leftrightarrow19,2R+307,2=24R\)
\(\Leftrightarrow307,2=4,8R\)
\(\Leftrightarrow R=64\)
Vậy kim loại là Cu

PTHH:
\(CuO+H_2\) \(\underrightarrow{t^o}\) \(Cu+H_2O\) \(\left(1\right)\)
\(Fe_2O_3+3H_2\) \(\underrightarrow{t^o}\) \(2Fe+3H_2O\) \(\left(2\right)\)
Số mol H2 là 0,6 mol
Gọi số mol H2 tham gia pư 1 là x mol \(\left(0,6>x>0\right)\)
Số mol H2 tham gia pư 2 là \(\left(0,6-x\right)mol\)
Theo PTHH 1:
\(n_{CuO}=n_{H_2}=x\left(mol\right)\)
Theo PTHH 2:
\(n_{Fe_2O_3}=\frac{1}{3}n_{H_2}=\left(0,6-x\right):3\left(mol\right)\)
Theo bài khối lượng hh là 40g
Ta có pt: \(80x+\left(0,6-x\right)160:3=40\)
Giải pt ta được \(x=0,3\)
Vậy \(n_{CuO}=0,3\left(mol\right);n_{Fe_2O_3}=0,1\left(mol\right)\)
\(\%m_{CuO}=\left(0,3.80.100\right):40=60\%\)
\(\%m_{Fe_2O_3}=\left(0,1.160.100\right):40=40\%\)
1)
PTHH: \(2Cu+O_2\) \(\underrightarrow{t^o}\) \(2CuO\)
x x
Gọi số mol Cu phản ứng là x mol ( x >0)
Chất rắn X gồm CuO và Cu
Ta có PT: 80x + 25,6 – 64x = 28,8
Giải PT ta được x = 0,2
Vậy khối lượng các chất trong X là:
\(m_{Cu}\) = 12,8 gam
\(m_{CuO}\) = 16 gam
2)
Gọi kim loại hoá trị II là A.
PTHH: \(A+2HCl\rightarrow ACl_2+H_2\)
Số mol \(H_2\)= 0,1 mol
Theo PTHH: \(n_A=n_{H_2}\)= 0,1 (mol)
Theo bài \(m_A\) = 2,4 gam \(\Rightarrow\) \(M_A\) = 2,4 : 0,1 = 24 gam
Vậy kim loại hoá trị II là Mg

1 ) CAO +H2O => CA(OH)2 (1)
2K + 2H2O => 2KOH + H2(2)
n (H2) =1,12/22,4 =0,05
theo ptpư 2 : n(K) = 2n (h2) =2.0.05=0,1(mol)
=> m (K) =39.0,1=3,9 (g)
% K= 3,9/9,5 .100% =41,05%
%ca =100%-41,05%=58,95%
xo + 2hcl =>xcl2 +h2o
10,4/X+16 15,9/x+71
=> giải ra tìm đc X bằng bao nhiêu thì ra

a.b.\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,1 0,3 0,2 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
c.\(n_{HCl}=\dfrac{125.14,6\%}{36,5}=0,5mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,2 < 0,5 ( mol )
0,2 0,2 0,2 ( mol )
\(m_{FeCl_2}=0,2.127=25,4g\)
\(m_{ddspứ}=\left(0,2.56\right)+125-0,2.2=135,8g\)
\(C\%_{FeCl_2}=\dfrac{25,4}{135,8}.100=18,7\%\)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\:\right)\\
Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
0,1 0,3 0,2
=> \(m_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(m_{HCl}=125.14,6\%=18,25\left(g\right)\)
\(m_{Fe}=0,2.56=11,2\left(g\right)\)
Fe + 2HCl →FeCl2 +H2
\(C\%=\dfrac{11,2}{18,25}.100\%=61,3\%\)

a) Ta có:
nMg= \(\frac{m_{Mg}}{M_{Mg}}=\frac{6}{24}=0,25\left(mol\right)\)
PTHH: Mg + 2HCl -> MgCl2 + H2 (1)
PTHH: 2H2 + O2 \(\underrightarrow{t^o}\) 2H2O (2)
b) Theo các PTHH và đề bài , ta có:
\(n_{H_2}\)= nMg= 0,25 (mol)
Thể tích khí H2 thu được (đktc):
=> \(V_{H_2\left(đktc\right)}=n_{H_2\left(1\right)}.22,4=0,25.22,4=5,6\left(l\right)\)
c) Ta có: \(n_{H_2\left(2\right)}=n_{H_2\left(1\right)}=0,25\left(mol\right)\)
Mà, ta lại có: \(n_{H_2O\left(2\right)}=n_{H_2\left(2\right)}=0,25\left(mol\right)\)
=> \(m_{H_2O\left(2\right)}=n_{H_2O\left(2\right)}.M_{H_2O}=0,25.18=4,5\left(g\right)\)

Câu 5. a) \(SO_2+\dfrac{1}{2}O_2-^{t^o,V_2O_5}\rightarrow SO_3\)
\(n_{SO_3}=n_{SO_2}=0,1\left(mol\right)\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{H_2SO_4}=n_{SO_3}=0,1\left(mol\right)\)
=> \(CM_{H_2SO_4}=\dfrac{0,1}{0,2}=0,5M\)
b) \(n_{Zn}=0,05\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Lập tỉ lệ : \(\dfrac{0,05}{1}< \dfrac{0,1}{1}\)=> Sau phản ứng H2SO4 dư
=> \(m_{H_2SO_4\left(dư\right)}=\left(0,1-0,05\right).98=4,9\left(g\right)\)
Câu 5 . \(n_{Al_2O_3}=0,2\left(mol\right);n_{H_2SO_4}=0,8\left(mol\right)\)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
Lập tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,8}{3}\) => Sau phản ứng H2SO4 dư
\(m_{H_2SO_4}=\left(0,8-0,2.3\right).98=19,6\left(g\right)\)
b)\(n_{Al_2\left(SO_4\right)_3}=n_{Al_2O_3}=0,2\left(mol\right)\)
\(m_{Al_2\left(SO_4\right)_3}=0,2.342=68,4\left(g\right)\)
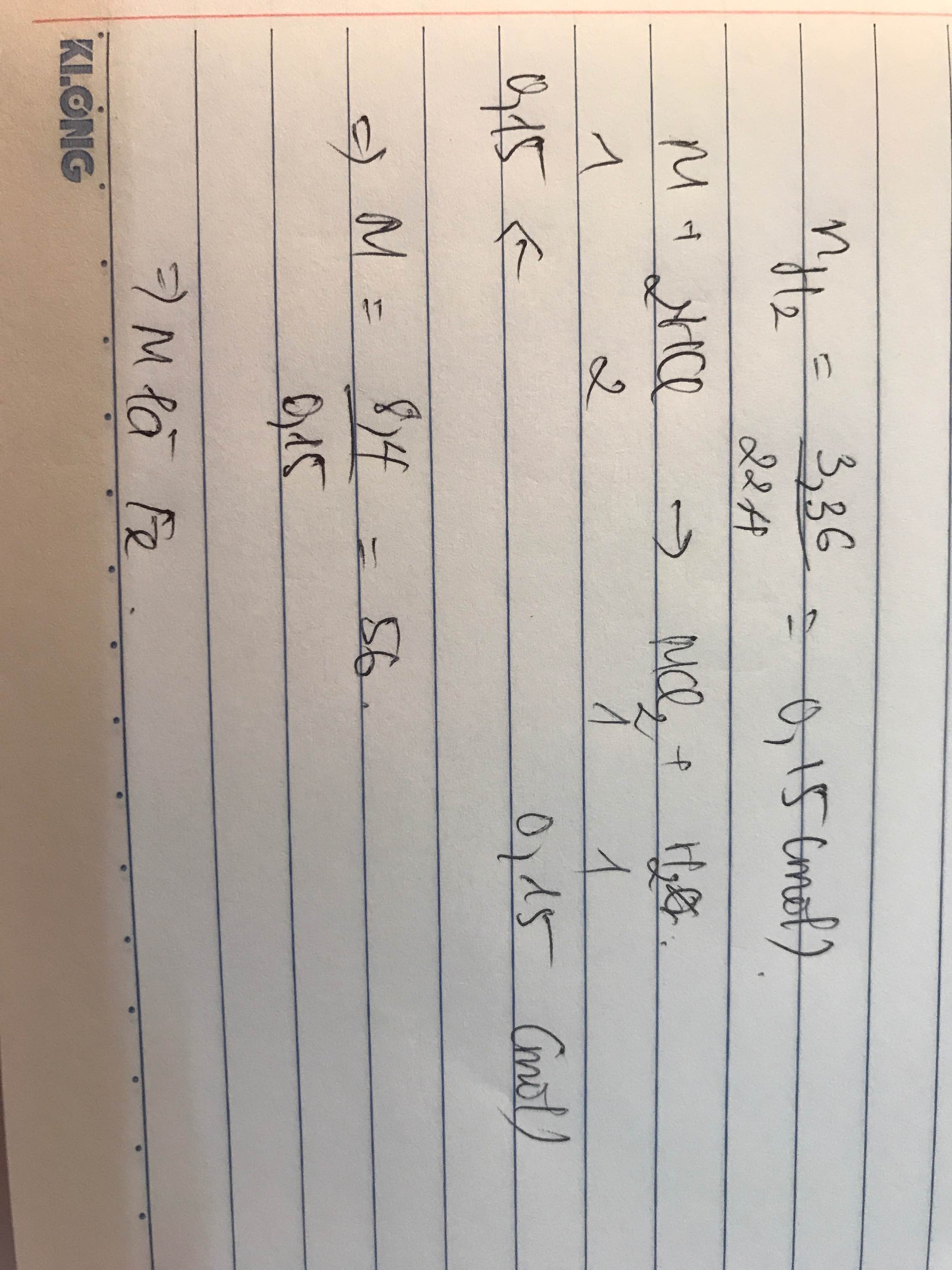
Câu 8:
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{0,2}{1}\), ta được O2 dư.
Theo PT: \(\left\{{}\begin{matrix}n_{O_2\left(pư\right)}=\dfrac{1}{2}n_{H_2}=0,05\left(mol\right)\\n_{H_2O}=n_{H_2}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2\left(dư\right)}=0,15.22,4=3,36\left(l\right)\)
\(m_{H_2O}=0,1.18=1,8\left(g\right)\)
Bạn tham khảo nhé!
Câu 9:
a, PT: \(2R+O_2\underrightarrow{t^o}2RO\)
Theo ĐLBT KL, có: mR + mO2 = mRO
⇒ mO2 = 4,8 (g)
\(\Rightarrow n_{O_2}=\dfrac{4,8}{32}=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,15.22,4=3,36\left(l\right)\)
b, Theo PT: \(n_R=2n_{O_2}=0,3\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{19,2}{0,3}=64\left(g/mol\right)\)
Vậy: M là đồng (Cu).
Câu 10:
Ta có: mBaCl2 = 200.15% = 30 (g)
a, m dd = 200 + 100 = 300 (g)
\(\Rightarrow C\%_{BaCl_2}=\dfrac{30}{300}.100\%=10\%\)
⇒ Nồng độ dung dịch giảm 5%
b, Ta có: \(C\%_{BaCl_2}=\dfrac{30}{150}.100\%=20\%\)
⇒ Nồng độ dung dịch tăng 5%.
Bạn tham khảo nhé!