Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) - Nếu dùng KMnO4:
2 KMNO4 + 16 HCl = 2 KCl + 2 MnCl2 + 8 H2O + 5 Cl2 (1)
- Nếu dùng MnO2:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (2)
Theo pt ta thấy (1) tạo ra 5Cl2 còn pư (2) chỉ tạo 1Cl2, chứng tỏ (1) tạo ra nhiều clo hơn (2).
b) giả sử số mol của KMnO4 và MnO2 là 0.2 mol
2 KMNO4 + 16 HCl = 2 KCl + 2 MnCl2 + 8 H2O + 5 Cl2 (1)
0.2.................................................................................0.5
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (2)
0.2........................................0.2
Ta thấy số mol Cl2 ở (1) lớn hơn số mol Cl2 ở (2), suy ra pư (1) tạo nhiều clo hơn (2).
c) Từ (1) và (2) ta thấy:
Số mol HCl (1) lớn gấp 4 lần số mol HCl ở (2), suy ra ở pư (1) tiêu tốn HCl hơn pư (2).
Để thu được nhiều Clo hơn ta nên dùng pư (1) , còn muốn tiết kiệm HCl ta nên dùng MnO2.

– Số mol KMnO4 = 0,2 (mol); số mol KOH = 2 (mol)
– Phương trình phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,2 0,5
* Ở điều kiện nhiệt độ thường:
Cl2 + 2KOH → KCl + KClO + H2O
0,5 1,0 0,5 0,5
– Dư 1,0 mol KOH
CM (KCl) = CM (KClO) = 0,5 (M); CM (KOH dư) = 1 (M)
* Ở điều kiện đun nóng trên 700C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
0,5 1,0 5/6 1/6
– Dư 1,0 mol KOH
CM (KCl) = 5/6 (M); CM (KClO3) = 1/6 (M); CM (KOH dư) = 1 (M).

- SO2
\(Na_2SO_3+2HCl->2NaCl+SO_2\uparrow+H_2O\)
- \(CO_2\)
\(NH_4HCO_3+HCl->NH_4Cl+CO_2+H_2O\)
- H2
\(2Al+6HCl->2AlCl_3+3H_2\)
- Cl2
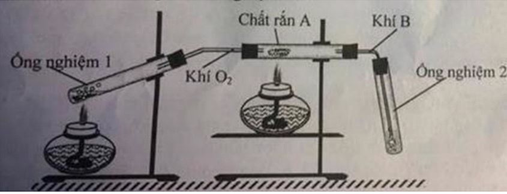
\(MnO_2+4HCl->MnCl_2+Cl_2+2H_2O\)
- NH3
\(NH_4HCO_3+Ba\left(OH\right)_2->BaCO_3+NH_3+2H_2O\)
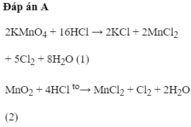

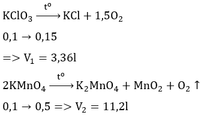
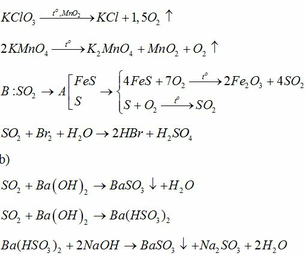

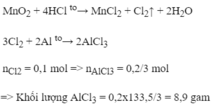
. 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (1)
a/158 mol ............................................... a/63,2 mol
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (2)
a/87 mol ..............................a/87mol
Ta có: a/63,2>a/87. Vậy khí clo ở phản ứng (1) thu được nhiều hơn phản ứng (2)
b. 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (1’)
amol 2,5a mol
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (2’)
amol a mol
Ta có 2,5a > a. Vậy dùng KMnO4 để điều chế thì thu được nhiều khí clo hơn so với dùng MnO2 khi lấy cùng khối lượng cũng như số mol.