Điện phân (với các điện cực trơ, màng ngăn) dung dịch chứa m gam hỗn hợp gồm Cu(NO3)2 và NaCl bằng dòng điện có cường độ 2,68A. Sau thời gian 6h, tại anot thoát ra 4,48 lít khí (đktc). Thêm 20 gam bột sắt vào dung dịch sau điện phân, thu được khí NO (sản phẩm khử duy nhất của NO3‒) và 12,4 gam chất rắn gồm hai kim loại. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 86,9
B. 77,5
C. 68,1
D. 97,5


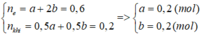
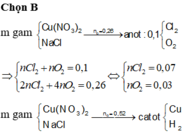
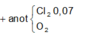



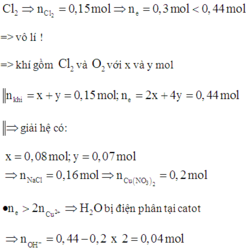
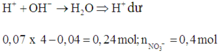
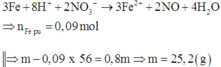




Đáp án A
Tại anot thoát ra 0,2 mol khí gồm Cl2 và O2 với số mol đều là 0,1 mol.
Cho 20 gam Fe vào dung dịch sau điện phân được 12,4 gam hai kim loại chứng tỏ Fe dư và trong dung dịch sau điện phân còn Cu2+.