X là hỗn hợp rắn gồm Mg, NaNO3 và FeO (trong đó oxi chiếm 26,4% về khối lượng). Hòa tan hết m gam X trong 2017 gam dung dịch H2SO4 loãng, nồng độ 10% thu được dung dịch Y chỉ chứa muối sunfat trung hòa và 11,2 lít (đktc) hỗn hợp khí gồm NO và H2 có tỉ khối so với H2 là 6,6. Cô cạn dung dịch Y thu được chất rắn khan Z và 1922,4 gam H2O. Phần trăm khối lượng của Mg trong X là
A. 45,5%
B. 26,3%
C. 33,6%
D. 32,4%

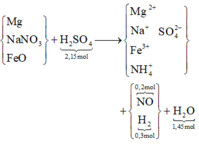
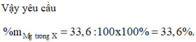
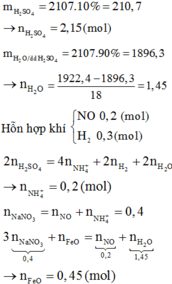
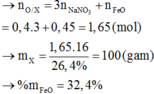



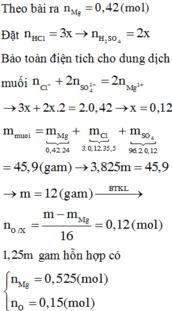



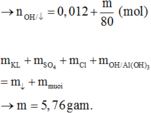
Đáp án C