Cho hỗn hợp gồm Ag: 0,05 mol, Cu: 0,1 mol, Zn: 0,1 mol trộn vào 200g dung dịch H2SO4 loãng dư thu được dung dich D. Tính C% các muối trong dung dịch D
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bảo toàn electron : $2n_{Cu} = 3n_{NO} + 8n_{N_2O} = 0,95(mol)$
$\Rightarrow n_{Cu} = 0,475(mol)$
$\Rightarrow m = 0,475.64 = 30,4(gam)$
Bảo toàn electron:
`2n_{Cu}=3n_{NO}+8n_{N_2O}`
`->n_{Cu}={3.0,05+8.0,1}/2=0,475(mol)`
`m_{Cu}=0,475.64=30,4(g)`

Dễ tính nFe=nMg=nCu=0,1 mol
Số mol hh khí=0,12 mol
Khối lượng muối của KL=57,8 gam <58,8
Vậy có NH4NO3 và =1 gam=> nNH4NO3=0,0125 mol
Bảo toàn e ta có:3nFe+2(nMg+nCu)=10nN2+3nNO+nNO2+8nN2O+8nNH4NO3
=>11nN2+3nNO+8nN2O=0,6 mol(1)
Và 2nN2+nNO+nN2O=0,12=> 6nN2+3nNO+3nN2O=0,36(2)
trừ (1) cho (2) ta được 5nN2+5nN2O=0,24
=> nN2+nN2O=0,048 và nNO+nNO2=0,072
Vậy số mol HNO3 = 3nFe + 2(nMg+nCu) + 2(nN2+nN2O) + (nNO2 + nNO) + 2nNH4NO3 = 0,893 mol
=> Đáp án B

Đáp án B
Theo giả thiết, suy ra trong Y có NO (khí không màu hóa nâu trong không khí).
Mặt khác, ![]() khí còn lại trong Y là H2. Vì đã có H2 sinh ra nên
NO
3
-
không còn trong dung dịch X.
khí còn lại trong Y là H2. Vì đã có H2 sinh ra nên
NO
3
-
không còn trong dung dịch X.
Theo giả thiết, bảo toàn nguyên tố N, bảo toàn electron, ta có :


Đáp án : A
Ta có : MY = 24,4 => Có H2. Lại có 1 khí hóa nâu ngoài không khí => NO
Áp dụng qui tắc đường chéo ta có : nH2= 0,025 mol ; nNO = 0,1 mol
Do Zn dư và tạo ra khí H2 => NO3 hết => trong dung dịch sau không còn NO3-
Bảo toàn N : nNH4+ = nNO3 ban đầu – nNO = 0,05 mol
=> 2nZn = 2nH2 + 3nNO + 8nNH4+ => 0,375 mol = nZn2+
Bảo toàn điện tích : 2nZn2+ + nNa+ + nK+ + nNH4+ = nCl
=> nCl- = 0,95 mol
=> m = 64,05g

Đáp án B
Hai khí thu được không màu, có một khí hóa nâu trong không khí là NO.
M Y = 2 . 12 , 2 = 24 , 4 < M NO => Chứng tỏ khí còn lại trong Y có PTK nhỏ hơn 24,4 => Đó là H2.
Đặt a, b lần lượt là số mol NO và H2
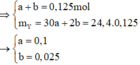
Vì phản ứng có tạo khí H2 nên NO 3 - đã phản ứng hết mà n NO < n NO 3 - => có muối amoni tạo thành, n NH 4 + = 0 , 05 + 0 , 1 - 0 , 1 = 0 , 05 mol
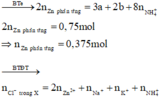
⇒ n Cl - trong X = 2 . 0 , 375 + 0 , 05 + 0 , 1 + 0 , 05 = 0 , 95 mol ⇒ m = m cation + m animon = 65 . 0 , 375 + 23 . 0 , 05 + 39 . 0 , 1 + 18 . 0 , 05 + 35 , 5 . 0 , 95 = 64 , 05 g
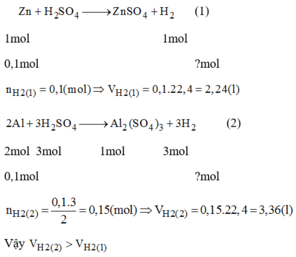
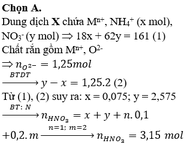

Ag và Cu không tác dụng được với H2SO4 loãng
Zn+H2SO4---->ZnSO4+H2
Muối sau pư chỉ có ZnSO4
Theo pthh
n ZnSO4=n Zn=0,1(mol)
m ZnSO4=0,1.161=16,1(g)
n H2=n Zn=0,1(mol)
m H2=0,2(g)
m dd sau pư=6,5+200-0,2=206,3(g)
C% ZnSO4=16,1/206,3.100%=7,8%
Zn + H2SO4 -> ZnSO4 + H2
0,1___0,1_____0,1___0,1(mol)
mZnSO4= 161.0,1= 16,1(g)
mddZnSO4= mZn+ mddH2SO4- mH2= 0,1 . 65+200- 0,1.2= 206,3(g)
=> C%ddZnSO4= (16,1/206,3).100=7,804%