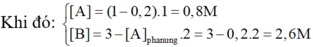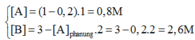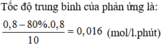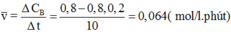Mọi người giúp mình bài này với ạ!!!
Cho phản ứng: A + 2B -> C
là phản ứng đơn giản có hằng số vận tốc ở nhiệt độ phản ứng là 0,8 M-1.phút-1. Nồng độ ban đầu chủa chất A là 0,02 M, chất B là 0,05 M. Tính tốc độ ban đầu và tốc độ phản ứng ở thời điểm nồng độ chất A còn 0,01M