cho 10 lít hỗn hợp khí A gồm C2H6,C2H4và H2 qua Niken nung nóng sau phản ứng thu được 8 lít hỗn hợp khí B gồm C2H6và H2 . Tính thể tích C2H4 trong A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



5.
\(n_X=\dfrac{2,24}{22,4}=0,1mol\\ M_X=2,125.4=8,5g\cdot mol^{^{ }-1}\\ n_{H_2}=a;n_{C_2H_4}=b\\ a+b=0,1\\ 2a+28b=8,5.0,1=0,85\\ a=0,075;b=0,025\\ H_2+C_2H_4-^{^{ }Ni,t^{^{ }0}}->C_2H_6\\ V_{C_2H_6}=0,025.22,4=0,56L;V_{H_2dư}=22,4\left(0,075-0,025\right)=1,12L\)
6.
Thu được Y chỉ gồm hydrocarbon nên khí hydrogen phản ứng hết.
\(n_A=\dfrac{4,48}{22,4}=0,2mol\\ n_Y=\dfrac{3,36}{22,4}=0,15mol\\ \Delta n_{hh}=n_{H_2\left(pư\right)}=0,05\left(mol\right)\\ n_{C_2H_4}=0,15\left(mol\right)\\ a.\%V_{H_2}=\dfrac{0,05}{0,2}=25\%\\ \%V_{C_2H_4}=75\%\\ b.BTLK\pi:0,15=0,05+n_{Br_2}\\ n_{Br_2}=0,1mol\)

N2 + 3H2 → 2NH3
Cứ 1 lít N2 phản ứng với 3 lít H2 tạo thành 2 lít NH3 thì thể tích giảm:
3 + 1 - 2 = 2 (lít)
Ở đây, tổng thể tích khí trước và sau phản ứng (đo cùng điều kiện) là 50 lít và 48 lít, tức giảm 2 lít.
Vậy V(NH3) = 2 lít
Nếu phản ứng hoàn toàn (100%) thì N2 phản ứng hết và H2 dư. Hiệu suất được tính theo N2:
H = (1/10).100% = 10%
*TK

Ta có: \(n_Y=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(\Rightarrow M_Y=\dfrac{1,32}{0,1}=13,2\left(g/mol\right)\)
→ Y gồm H2 dư và C2H6.
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2\left(dư\right)}+n_{C_2H_6}=0,1\\2n_{H_2\left(dư\right)}+30n_{C_2H_6}=1,32\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{H_2\left(dư\right)}=0,06\left(mol\right)\\n_{C_2H_6}=0,04\left(mol\right)\end{matrix}\right.\)
Gọi: \(\left\{{}\begin{matrix}n_{H_2}=x\left(mol\right)\\n_{C_2H_2}=n_{C_2H_4}=y\left(mol\right)\end{matrix}\right.\)
BTNT C: 2y = 0,04 ⇒ y = 0,02 (mol)
Có: nH2 (pư) = 2nC2H2 + nC2H4 = 0,06 (mol)
⇒ nH2 = 0,06 + 0,06 = 0,12 (mol)
\(\Rightarrow V=\left(0,12+0,02+0,02\right).22,4=3,584\left(l\right)\)

Gọi : \(n_{C_2H_2} = a(mol); n_{H_2} = b(mol)\)
⇒ a + b = \(\dfrac{10,08}{22,4} = 0,45(1)\)
Vì sau phản ứng ,H2 hết
Suy ra: \(n_Y = n_X - n_{H_2} = 0,45 - b(mol)\)
Bảo toàn khối lượng :
\(m_X = m_Y\\ \Leftrightarrow 26a + 2b = (0,45-b).7,125.4\\ \Leftrightarrow 26a + 30,5b = 12,825(2)\)
Từ (1)(2) suy ra a = 0,2 ; b = 0,25
Vậy :
\(\%V_{C_2H_2} = \dfrac{0,2}{0,45}.100\% = 44,44\%\\ \%V_{H_2} = 100\%- 44,44\% = 55,56\%\)

Đáp án B
Khi hỗn hợp A qua dung dịch brom thì khí thoát ra gồm các ankan (không tính lượng C4H10 dư), H2 và
C4H10 dư chỉ có anken phản ứng.
Ta có:
![]()
![]()
![]()
![]() (lít)
(lít)

Giả sử các khí được đo ở điều kiện sao cho 1 mol khí chiếm thể tích 1 lít
Gọi số mol CH4, C2H6 là a, b (mol)
=> \(a+b=\dfrac{25}{1}=25\left(mol\right)\) (1)
\(n_{O_2}=\dfrac{95}{1}=95\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
a---->2a---------->a
2C2H6 + 7O2 --to--> 4CO2 + 6H2O
b------>3,5b-------->2b
=> \(\left\{{}\begin{matrix}n_{O_2\left(dư\right)}=95-2a-3,5b\left(mol\right)\\n_{CO_2}=a+2b\left(mol\right)\end{matrix}\right.\)
=> \(95-a-1,5b=\dfrac{60}{1}=60\)
=> a + 1,5b = 35 (2)
(1)(2) => a = 5; b = 20
=> \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{5}{25}.100\%=20\%\\\%V_{C_2H_6}=\dfrac{20}{25}.100\%=80\%\end{matrix}\right.\)
\(\overline{M}_A=\dfrac{5.16+20.30}{5+20}=27,2\left(g/mol\right)\)
\(\overline{M}_B=20,5.2=41\left(g/mol\right)\)
=> \(d_{A/B}=\dfrac{27,2}{41}\approx0,663\)

Đáp án D
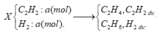
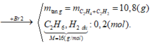
Bảo toàn khối lượng ta có:
mX = mC2H4+C2H2 dư + mC2H6+H2 dư = 10,8 + 0,2.16 = 14 (g)
=> 26a+ 2a = 14
=> a = 0,5 (mol)
Đốt hỗn hợp Y giống như đốt hỗn hợp X nên ta có:
C2H2 + 2,5O2 → 2CO2 + H2O
0,5 →1,25 (mol)
H2 + 0,5O2 → H2O
0,5 →0,25 (mol)
=> ∑ nO2 = 1,25 + 0,25 = 1,5 (mol)
=> VO2(đktc) = 1,5.22,4 = 33,6 (lít)

Ta thấy thể tích hidrocacbon sau khi tham gia phản ứng cộng H 2 không thay đổi, chỉ có thể tích giảm đi là H 2 vào Hidrocacbon.
Suy ra: VX = 6,72 lit
⇒ Chọn A.