Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Liên kết cộng hoá trị SVIP
I. LIÊN KẾT CỘNG HOÁ TRỊ
- Ngoài cách nhường và nhận electron để hình thành hợp chất ion, quy tắc octet có thể đạt được bằng cách góp chung electron.
- Electron dùng chung là electron được coi như thuộc về đồng thời hai nguyên tử tham gia liên kết.
- Liên kết do sự dùng chung cặp electron là loại liên kết rất phổ biến, thường gặp giữa phi kim với phi kim.
Liên kết cộng hoá trị là liên kết được hình thành bởi một hay nhiều cặp electron dùng chung giữa hai nguyên tử.
- Công thức Lewis biểu diễn cấu tạo phân tử qua các liên kết (cặp electron dùng chung) và các electron hoá trị riêng.
Ví dụ 1: Sự hình thành liên kết đơn trong phân tử HCl

Giữa nguyên tử hydrogen và nguyên tử chlorine trong phân tử HCl có một cặp electron chung, được biểu diễn bằng một gạch nối “\(-\)”, đó là liên kết đơn.
⇒ Do đó liên kết trong phân tử HCl được biểu diễn là H \(- \ \)Cl.
Ví dụ 2: Sự hình thành liên kết đôi trong phân tử CO2
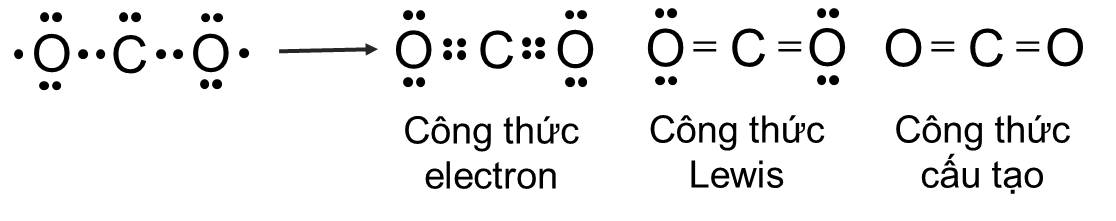
Giữa hai nguyên tử C và O trong phân tử CO2 có hai cặp electron chung, được biểu diễn bằng hai gạch nối “\(=\)”, đó là liên kết đôi.
⇒ Do đó liên kết trong phân tử CO2 được biểu diễn là C \(=\) O.
Ví dụ 3: Sự hình thành liên kết ba trong phân tử N2
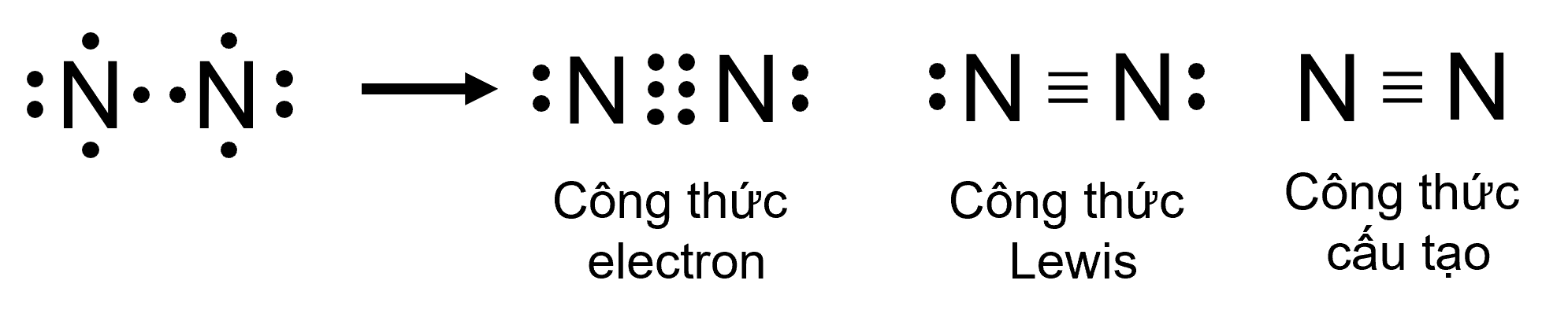
Giữa hai nguyên tử nitrogen trong phân tử N2 có ba cặp electron chung, được biểu diễn bằng ba gạch nối “\(\equiv\)”, đó là liên kết ba.
⇒ Do đó liên kết trong phân tử N2 được biểu diễn là N \(\equiv\) N.
Ví dụ 4: Sự hình thành liên kết cho - nhận trong ion ammonium
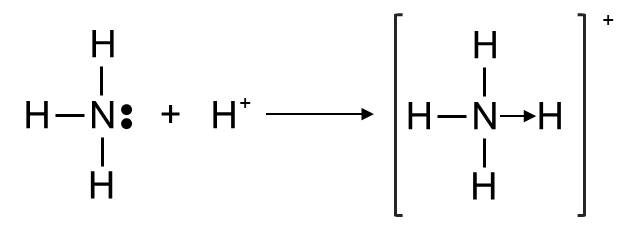
- Trên nguyên tử N của NH3 còn một cặp electron chưa tham gia liên kết. Khi NH3 kết hợp với ion H+ để hình thành ion \(NH_4^+\), cặp electron này được dùng chung giữa N và H+, vậy là sau khi hình thành liên kết, N có 8 electron lớp ngoài cùng, H có 2 electron lớp ngoài cùng, thoả mãn quy tắc octet.
- Vì cặp electron dùng chung chỉ do nguyên tử N đóng góp nên liên kết giữa N và ion H+ là liên kết cho nhận, kí hiệu là →, xuất phát từ N vì N là nguyên tử đóng góp electron.
⇒ Do đó liên kết trong ion ammonium được biểu diễn là N → H .
Liên kết cho - nhận là liên kết cộng hoá trị và cặp electron dùng chung được đóng góp từ một nguyên tử.
II. PHÂN LOẠI LIÊN KẾT DỰA THEO ĐỘ ÂM ĐIỆN
- Người ta có thể dựa vào hiệu độ âm điện (Δχ) giữa hai nguyên tử tham gia liên kết để dựa đoán loại liên kết giữa chúng.
- Để tính hiệu độ liên kết giữa hai nguyên tử A và B:
Δχ = χ(B) - χ(A), trong đó χ(B) ≥ χ(A)
- Khi biết hiệu độ âm điện, người ta có thể dự đoán được loại liên kết:
- 0 ≤ Δχ < 0,4: Liên kết cộng hoá trị không cực.

- 0,4 ≤ Δχ < 1,7: Liên kết cộng hoá trị có cực.

- Δχ > 1,7: Liên kết ion

III. LIÊN KẾT SIGAM (σ) và LIÊN KẾT PI (π)
Để tạo nên một cặp electron dùng chung, hai AO chứ electron độc thân (hoặc giữa 1 AO trống và 1 AO bão hoà electron) cần xen phủ với nhau.
Liên kết σ là loại liên kết cộng hoá trị được hình thành do sự xen phủ trục của hai orbital. Vùng xen phủ nằm trên đường nối tâm hai nguyên tử
- Các loại xen phủ trục:
- Xen phủ trục s - s
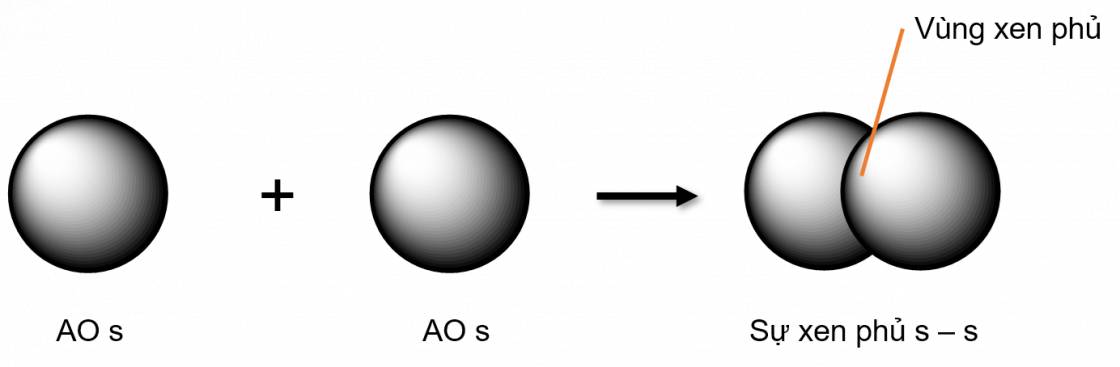
- Xen phủ trục s - p
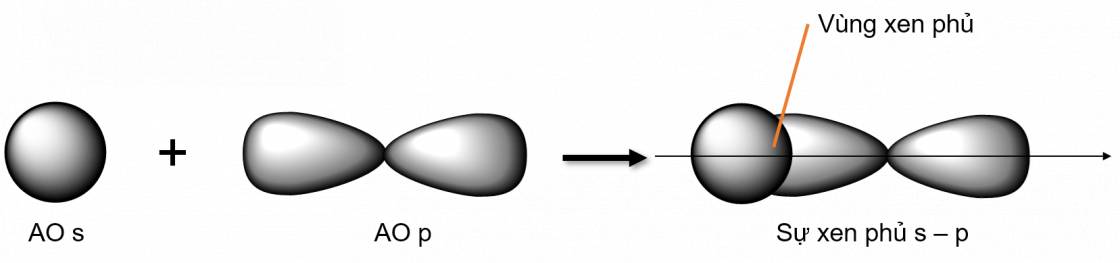
- Xen phủ trục p - p
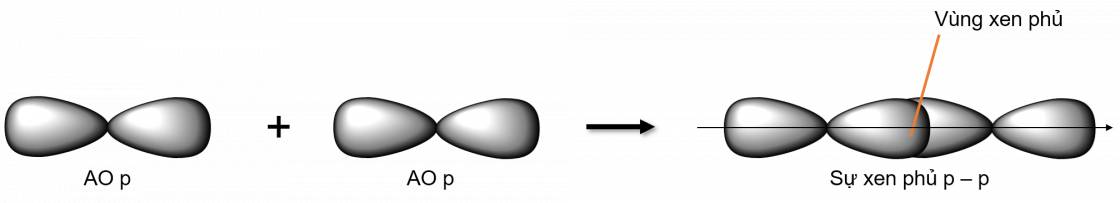
Liên kết π là loại liên kết cộng hoá trị được hình thành do sự xen phủ bên của hai orbital. Vùng xen phủ nằm hai bên đường nối tâm hai nguyên tử.
- Xen phủ bên p - p
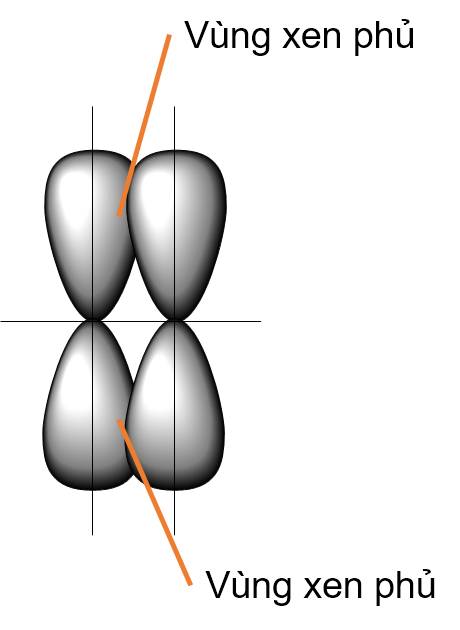
- Liên kết đơn còn gọi là liên kết σ.
- Liên kết đôi gồm một liên kết σ và một liên kết π.
- Liên kết đôi gồm một liên kết σ và hai liên kết π.
IV. NĂNG LƯỢNG CỦA LIÊN KẾT CỘNG HOÁ TRỊ
- Khi các nguyên tử liên kết với nhau sẽ tạo thành một hệ bền vững hơn, quá trình này giải phóng năng lượng. Do vậy để phá vỡ liên kết giữa các nguyên tử cần cung cấp năng lượng.
Năng lượng liên kết (Eb) là năng lượng cần thiết để phá vỡ một liên kết xác định trong phân tử ở thể khí, tại 25oC và 1 bar. Năng lương liên kết càng lớn, liên kết đó càng bền.
- Đơn vị của Eb: kJ/mol.
Các em đã học:
1. Liên kết cộng hoá trị được hình thành bởi một hay nhiều cặp electron dùng chung giữa hai nguyên tử.
2. Công thức Lewis là công thức biểu diễn cấu tạo phân tử qua các liên kết và các electron hoá trị riêng.
3. Liên kết cho - nhận là liên kết cộng hoá trị mà cặp electron dùng chung được đóng góp từ một nguyên tử.
4. Dựa vào hiệu độ âm điện, có thể dự đoán liên kết thuộc loại liên kết ion, liên kết cộng hoá trị không cực hay có cực.
5. Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma (σ). Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi (π). Liên kết σ bền hơn liên kết π.
6. Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết xác định trong phân tử ở thể khí, tại 25oC và 1 bar. Đơn vị của năng lượng liên kết thường là kJ.mol-1. năng lượng liên kết càng lớn, liên kết đó càng bền.

Bạn có thể đánh giá bài học này ở đây