Hỗn hợp X gồm hai oxit kim loại N a 2 O v à R O .Cho hỗn hợp X vào nước được dung dịch X 1 . Nhỏ từ từ dung dịch H 2 S O 4 vào dung dịch X 1 , sau một thời gian được kết tủa X 2 và dung dịch KOH. Nếu cho dung dịch HCl dư vào kết tủa X 3 thì thấy kết tủa tan hết. Nhỏ dung dịch KOH vào dung dịch X 3 lại thấy xuất hiện kết tủa. Kim loại R là kim loại nào sau đây?
A. Zn
B. Ba
C. Al
D. Mg

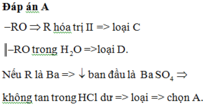
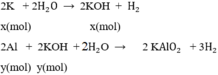
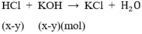
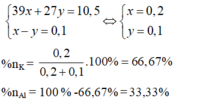
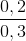 .100% = 66,67%;
.100% = 66,67%;
Đáp án A
-RO hóa trị II => loại C
-RO trong H 2 O =>loại D.
Nếu R là Ba =>ban đầu là B a S O 4 không tan trong HCl dư
=> loại => chọn A