Tổng các hạt electron, proton, nơtron trong ion R2+ là 34. Nhận xét nào sau đây không đúng?
A. Để điều chế R có thể dùng phương pháp nhiệt luyện.
B. Nguyên tố R thuộc chu kì 3, nhóm IIA.
C. R có trong khoáng vật cacnalit.
D. R có tính khử mạnh hơn Cu.


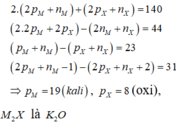
Đáp án A
Giải thích :
Từ giả thiết, suy ra :
Mg là kim loại có tính khử mạnh nên chỉ có thể điều chế bằng phương pháp điện phân nóng chảy.