Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Đáp án C
- Từ [OH-]= 1,5.10-5 (M) suy ra:
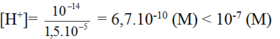
Vậy môi trường của dung dịch là kiềm.

Có [OH-] = 10-5
=> pH = 14 - 5 = 9 > 7
=> Môi trường dung dịch là kiềm
=>D

nOH-=0,5.2.0,2=0,2 mol
mHCL=200.1,05=210g=> mHCL=210.10/100=21g
n H+=nHCL=21/36,5=0,57 mol =>nH+>nOH-=>dd thu được có tính axit
nBa(OH)2 = 0.2*0.5=0.1 mol
mddHCl= V*d=200*1.05=210g
=> mHCl =210*10/100=21g
=> nHCl =21/36.5=\(\dfrac{42}{73}\) \(\approx\) 0.575mol
PTHH: 2HCl + Ba(OH)2 ----> BaCl2 + H2O
\(\dfrac{42}{73}\) 0.1
Ta thấy HCl dư \(\dfrac{137}{730}\) mol
Vậy dd thu được vẫn còn axit.

Đáp án A
nH+ = 0,04V1 (mol); nOH-= 0,035V2 (mol)
H++ OH- → H2O
Dung dịch sau phản ứng có pH = 2 nên axit dư
nH+ dư = 0,04V1- 0,035V2
[H+]dư = nH+ dư/ Vdd = (0,04V1- 0,035V2)/(V1+ V2) = 10-2
Suy ra V1/V2 = 3/2
\(n_{NaOH}=\dfrac{8}{40}=0,2mol\)
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\)\(mol\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2 0,2
Dung dịch thu được là \(Na_2SO_4\) có môi trường trung hòa.