Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

C H 3 C O O H ↔ C H 3 C O O - + H + ( 1 )
C H 3 C O O N a phân li trong dung dịch như sau :
C H 3 C O O N a → C H 3 C O O - + N a +
Sự phân li của C H 3 C O O H là quá trình thuận nghịch. Đây là cân bằng động. Khi hoà tan C H 3 C O O N a vào thì nồng độ C H 3 C O O - tăng lên, làm cho cân bằng (1) chuyển dịch từ phải sang trái, nên nồng độ H + giảm xuống.

Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
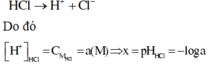
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
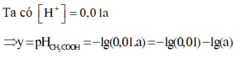
![]()
Đáp án A.

\(a.n_{H^+}=0,025.0,025.2=\dfrac{1}{800}\left(mol\right)\\ \left[H^+\right]=\dfrac{\dfrac{1}{800}}{0,1+0,025}=0,01\left(M\right)\\ \Rightarrow pH=-log\left[0,01\right]=2\\ b.n_{OH^-}=0,0025.0,1=0,00025\left(mol\right)\\ \left[OH^-\right]=\dfrac{0,00025}{0,4+0,1}=\dfrac{1}{2000}\left(M\right)\\ pH=14+log\left[\dfrac{1}{2000}\right]=10,69897\)


Đáp án B
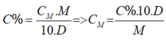
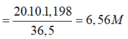
Theo đề bài pha loãng dung dịch thành dd 2M
=> Số lần = 6,56 : 2 = 3,28 lần

Giải thích các bước giải:
pH = 9 → [H+] = 10−9(M)
[H+].[OH-]=10−14
→ [OH-] = 10−5(M)
→ nOH- = 10−5 . 1 = 10−5(mol)
pH=8 → [H+] = 10−8(M)
[H+].[OH-]=10−14
→ [OH-] = 10−6(M)
Gọi x lít là thể tích nước cần dùng
Ta có
\(\dfrac{10^{-5}}{x+1}\)= 10-6
→x=9
Chọn câu C.9 lít


Từ phương trình => a=KC−−√
Với a độ điện li, K hằng số phân li, C nồng độ mol
để a tăng 2 lần =>KC−−√ tăng 2 lần. Mà K = const ( chỉ thay đổi bởi nhiệt độ và bản chất)
Vậy C giảm 4 lần
C = n/V
n = const ( số mol chất đầu)
Vậy V tăng 4 lần.
V đầu = 300ml
=> Vsau = 1200 ml
=> nước phải thêm 900ml