Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A.
nAl(OH)3= 7 , 8 78 = 0 , 1
2NaOH + H2SO4 à Na2SO4 + 2H2O (1)
0,2 ß 0,1
Để NaOH phản ứng nhiều nhất thu được 0,1 mol kết tủa Al(OH)3 thì Al2(SO4)3 phải phản ứng hết tạo kết tủa tối đa, sau đó kết tủa tan một phần sao cho lượng kết tủa cuối cùng thu được bằng 0,1 mol.
6NaOH + Al2(SO4)3 à 3Na2SO4 + 2Al(OH)3 (2)
0,6 ß 0,1 à 0,2
NaOH + Al(OH)3 à NaAlO2 + 2H2O (3)
0,1 ß 0,1
Từ (1), (2) và (3) ta có:
nNaOH pư = 0,6 + 0,1 + 0,2 = 0,9 mol
è → Vdd NaOH = 0,9 : 2 = 0,45 M

Đáp án D
V có giá trị lớn nhất vậy có các phương trình

Vậy nNaOH = 0,9 ⇒ V = 0,45

Đáp án C
Bản chất phản ứng là :
Lượng NaOH dùng nhiều nhất để tạo ra 0,1 mol Al OH 3 khi xảy ra cả phản ứng (3). Suy ra dung dịch sau phản ứng có chứa các ion SO 4 2 - , Na + , Al OH 4 -
Trong đó :
n SO 4 2 - = n H 2 SO 4 + 3 n Al 2 so 4 3 = 0 , 4 mol
n Al OH 4 - = n Al 3 + - n Al OH 3 = 2 n Al 2 ( SO 4 ) 3 - n Al OH 3 = 0 , 1 mol
Áp dụng bảo toàn điện tích cho dung dịch sau phản ứng, ta có :
n NaOH = n Na + = n Al OH 4 - + 2 n SO 4 2 - = 0 , 9 mol
⇒ V dd NaOH 2 M = 0 , 45 lit

Đáp án C
Ta có :
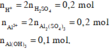
Dựa vào bản chất phản ứng và giả thiết, ta có đồ thị :

Dựa vào dạng hình học của đồ thị, ta thấy :
n Al ( OH ) 3 = 0 , 1 mol ⇒ n NaOH max = 0 , 9 mol ⇒ V dd NaOH 2 M = 0 , 9 2 = 0 , 45 lít

Chọn đáp án C
● Gọi số mol NaOH dùng ở lần 1 là a mol ta có sơ đồ.
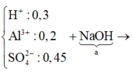
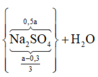
● ⇒ Với nNaOH = (a + 0,45) mol thì nAl(OH)3 = a - 0 , 3 6
+ Ta có sơ đồ:

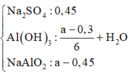
⇒ Ta có nAl(OH)3 = 4nAl(OH)3 – (nNaOH – nH+)
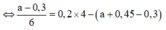
a = 0,6 mol ⇒ VNaOH = 0,6 lít = 600 ml ⇒ Chọn C


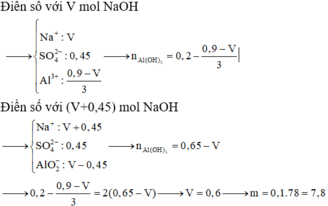
Khi cho NaOH vào, theo thứ tự sẽ xảy ra phản ứng với H2SO4. Bao giờ trung hoà hết axit mới phản ứng tiếp với Al2(SO4)3.
2 NaOH + H2SO4 -----> Na2SO4 + 2 H2O (1)
Al2(SO4)3 + 6 NaOH -----> 2 Al(OH)3 + 2 Na2SO4 (2)
Al(OH)3 + NaOH -----> NaAlO2 + 2 H2O (3)
Đầu tiên muốn tạo ra kết tủa thì ít nhất phải trung hoà hết axit đã. Từ (1) ta suy ra số mol NaOH để trung hoà hết H2SO4 = 2 x 0,2 = 0,4 (mol).
Kết tủa là Al(OH)3, ứng với số mol là:
11,7 : 78 = 0,15 (mol).
Đến đây ta chia làm hai trường hợp:
- Trường hợp 1 là chỉ xảy ra phản ứng (2) thôi (vì thiếu NaOH).
Từ (2) ta suy ra số mol NaOH cần dùng là 0,15 x 3 = 0,45 (mol).
Giá trị nhỏ nhất của V là (0,45 + 0,4) : 2 = 0,425 (lít).
- Trường hợp 2 là NaOH sau khi đã kết tủa toàn bộ chỗ Al2(SO4)3 rồi vẫn còn dư, nên hoà tan mất một phần kết tủa.
Từ (2) suy ra lượng NaOH cần để kết tủa hết muối nhôm là 0,1 x 6 = 0,6 (mol).
Cũng từ (2) suy ra số mol kết tủa là 0,1 x 2 = 0,2 (mol).
Có 0,2 mol kết tủa mà kết thúc chỉ còn lại 0,15 mol, suy ra NaOH hoà tan mất 0,2 - 0,15 = 0,05 (mol)
Vậy giá trị lớn nhất của V là: (0,4 + 0,6 + 0,05) : 2 = 0,525 (mol).
Nguồn