đốt cháy hoàn toàn 7 gam một hiđrocacbon X thì thu được 9 gam H²O. Xác định CTPT của X, biết khối lượng mol của X là 28g/mol.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: \(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\Rightarrow n_H=0,5.2=1\left(mol\right)\)
\(n_{CO_2}=\dfrac{22}{44}=0,5\left(mol\right)=n_C\)
Gọi CTPT của X là CxHy.
⇒ x:y = 0,5:1 = 1:2
→ CTPT của X có dạng là (CH2)n. ( n nguyên dương)
Mà: MX < 30
\(\Rightarrow n< \dfrac{30}{12+2.1}=2,14\)
n = 1 → không thỏa mãn hóa trị của C.
n = 2 (tm)
Vậy: CTPT của X là C2H4.

Ta có: \(n_{CO_2}=\dfrac{13,2}{44}=0,3\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\Rightarrow n_H=0,3.2=0,6\left(mol\right)\)
Giả sử: CTPT của A là CxHy
⇒ x : y = 0,3 : 0,6 = 1 : 2
⇒ CTĐGN của A là (CH2)n
Mà: MA = 28 (g/mol)
\(\Rightarrow n=\dfrac{28}{12+2}=2\)
Vậy: A là C2H4.
Bạn tham khảo nhé!

nC = nCO2 = 8,8/44 = 0,2 (mol)
nH = 2 . nH2O = 2 . 5,4/18 = 0,6 (mol)
nO = (4,6 - 0,2 . 12 - 0,6)/16 = 0,1 (mol)
CTPT: CxHyOz
=> x : y : z = 0,2 : 0,6 : 0,1 = 2 : 6 :1
(C2H6O)n = 46
=> n = 1
=> CTPT: C2H6O

Sửa đề :thu được \(m_{H_2O}=5,4g\)
Bảo toàn C:\(n_C=n_{CO_2}=\dfrac{13,2}{44}=0,3mol\)
Bảo toàn H:\(n_H=2.n_{H_2O}=2.\dfrac{5,4}{18}=0,6mol\)
\(n_O=\dfrac{9-\left(0,3.12+0,6.1\right)}{16}=0,3mol\)
---> A gồm có C,H và O
\(M_A=30.2=60\) ( g/mol )
Gọi \(CTPT:C_xH_yO_z\)
\(x:y:z=0,3:0,6:0,3=3:6:3\)
\(CTĐG:\left(C_3H_6O_3\right)n=60\)
\(\Leftrightarrow n=\dfrac{2}{3}\)
\(\rightarrow CTPT:C_2H_4O_2\)

1)
\(n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
=> nC = 0,2 (mol)
Số nguyên tử C = \(\dfrac{0,2}{0,1}=2\) (nguyên tử)
\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\)
=> nH = 0,4 (mol)
Số nguyên tử H = \(\dfrac{0,4}{0,1}=4\) (nguyên tử)
CTPT: C2H4
CTCT: \(CH_2=CH_2\) (etilen)
2)
a) Khí thoát ra là C2H4
\(\%V_{C_2H_4}=\dfrac{0,84}{3,36}.100\%=25\%\)
b)
PTHH: \(CH\equiv CH+2AgNO_3+2NH_3\rightarrow CAg\equiv CAg\downarrow+2NH_4NO_3\)
\(n_{C_2H_2}=\dfrac{3,36-0,84}{22,4}=0,1125\left(mol\right)\)
=> \(n_{C_2Ag_2}=0,1125\left(mol\right)\)
=> m = 0,1125.240 = 27 (g)
1)
\(n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
=> nC = 0,2 (mol)
Số nguyên tử C = \(\dfrac{0,2}{0,1}=2\) (nguyên tử)
\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\)
=> nH = 0,4 (mol)
Số nguyên tử H = \(\dfrac{0,4}{0,1}=4\) (nguyên tử)
CTPT: C2H4
CTCT: \(CH_2=CH_2\) (etilen)
2)

Gọi công thức của hai hiđrocacbon là C n H 2 n , C m H 2 m với m > n > 2
Phương trình hoá học :
C n H 2 n + 3n/2 O 2 → n CO 2 + n H 2 O
C m H 2 m + 3m/2 O 2 → m CO 2 + m H 2 O
n hh = 8,96/22,4 = 0,4 mol
n C m H 2 m = 0,4/100 x 25 = 0,1 mol
n C n H 2 n = 0,4 - 0,1 = 0,3 mol
Theo phương trình hóa học: n H 2 O = n CO 2 = 40,6/44 = 0,9 mol
Vậy 8,96 lít hỗn hợp X có khối lượng:
m X = m C + m H = 0,9 x 12 + 0,9 x 2 = 12,6g
Ta có n CO 2 = 0,3n + 0,1m = 0,9 => 3n + m = 9
=> n = 2; m = 3. Công thức của 2 hidrocacbon C 2 H 4 và C 3 H 6
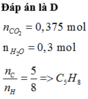
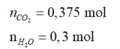
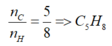
Đặt \(X=C_xH_y\)
\(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\)
=>\(n_H=1\left(mol\right)\)
\(n_C=\dfrac{7-1\cdot1}{12}=\dfrac{6}{12}=0,5\left(mol\right)\)
x:y=0,5:1=1:2
=>\(X=\left(CH_2\right)_n\)
=>\(n=\dfrac{28}{12+2}=2\)
=>\(X=C_2H_4\)