Hợp chất ion A được tạo thành từ các ion thuộc hai nguyên tố hóa học. Các ion đều có cấu hình electron là: 1s22s22p63s23p6.
Một phân tử A có tổng số hạt proton, notron và electron là 164.
Xác định CTPT có thể có của A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nhận thấy hợp chất A có dạng X2Y.
Dễ nhận thấy X+ trong tất cả các đáp án là NH4+ hoặc lập luận như sau:
• Với ion X+ chứa 5 hạt nhân của 2 nguyên tố → X có dạng AaBb+ với a+ b = 5
Trong X+ có 10 electron → Ztb =
10
+
1
5
= 2,2 → trong X chắc chắn chứa H → X có dạng HaBb
Với a = 1, b= 4 → ZB =
11
-
1
4
= 2,5 loại
Với a = 2, b= 3 → ZB =
11
-
2
3
= 3 ( loại do B(Z= 3) không tạo được liên kết ion với H)
Với a = 3, b= 2 → ZB =
11
-
3
2
= 4 ( Loại do không tồn tại ion C2H3+)
Với a= 4, b= 1 → ZB =
11
-
4
1
= 7 (N) → X là NH4+ ( thỏa mãn)
•Trong ion Y2- có bốn hạt nhân → Y có dạng CcDd với c + d= 4 ( Loại C, D)
Trong ion Y2- có bốn hạt nhân thuộc hai nguyên tố trong cùng một chu kì và đứng cách một ô trong bảng hệ thống tuần hoàn. → ZD = ZC + 2
Với c=1, d= 3 → ZC + 3. (ZC +2) = 30 → ZC = 6 ( C) → ZD = 8(O). Vậy Y2- có công thức CO32-.
Với c= 2,d= 2 → 2ZC + 2. (ZC +2) = 30 → ZC = 6,5 ( loại)
Với c= 3, d= 1→ 3ZC + (ZC +2) = 30 → ZC = 7 (N), ZD = 9 (F) → loại do không tạo được ion N3F2-.
Công thức của A là (NH4)2CO3.
Đáp án A.

Đáp án B
Anion có cấu hình1s22s22p6 => Anion là F hoặc O
Cation có cấu hình1s22s22p6 => Cation là Na hoặc Mg
Nếu anion là O, tổng số hạt p,n,e trong X là 92, X là Na2O (2pNa + nNa) + (2pO + nO) = 92
Tổng số hạt trong Y là 60, vậy Y là MgO.
Nếu anion là F.
Tổng số hạt trong X là 92. X là MgF2

Đáp án B
![]()
![]()
![]()
![]()
- Giả sử anion là O
+ Tổng số hạt p, n, e trong phân tử X là 92. =>X là Na2O (2 × (11 × 2 + 12) + (8 × 2 + 8) = 92).
+ Tổng số hạt p, n, e trong phân tử Y là 60. =>Y là MgO ((12 × 2 + 12)+ (8 × 2 + 8) = 60).
- Giả sử anion là F
+ Tổng số hạt trong phân tử X là 92. => X là MgF2 ( (12 × 2 + 12) + 2 × (9 × 2 + 10) = 92)

Đáp án C.
Gọi p, e, n là số proton, số electron và số nơtron trong một nguyên tử M; p’, e’, n’ là số proton, số electron và số nơtron trong một nguyên tử X.
Trong nguyên tử số proton = số electron; các hạt mang điện là proton và electron, hạt không mang điện là nơtron.
+ Trong phân tử của M2X2 có tổng số hạt proton, nơtron và electron là 164 nên suy ra:
2(2p + n) + 2(2p’ + n’) = 164 (1)
+ Trong đó số hạt mang điện nhiều hơn hạt không mang điện là 52 nên suy ra:
(4p + 4p’) - 2(n + n’) = 52 (2)
+ Số khối của M lớn hơn số khối của X là 23 đơn vị nên ta có suy ra:
(p + n) - (p’ + n’) = 23 (3)
+ Tổng số hạt electron trong M+ nhiều hơn trong X22- là 7 hạt nên suy ra:
(2p + n - 1) - 2(2p’ + n’) + 2 = 7 (4)
Giải hệ (1), (2), (3), (4) ta được p = 19 ⇒ M là kali; p’ = 8 ⇒ X là oxi.
Công thức phân tử của hợp chất là K2O2.

Đáp án D
Hợp chất Y được cấu tạo từ ion M+ và ion X- Hợp chất Y là MX
Theo giả thiết ta có:
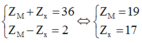
=> M là Kali và X là Cl
K có cấu hình electron là: 1s22s22p63s23p64s1
=> K thuộc chu kì 4; nhóm IA
Cl có cấu hình electron là: 1s22s22p63s23p5
=> Cl thuộc chu kì 3; nhóm VIIA

Đáp án D
Hợp chất Y được cấu tạo từ ion M+ và ion X-
⇒ Hợp chất Y là MX
Theo giả thiết ta có:

⇒ M là Kali và X là Cl
K có cấu hình electron là: 1s22s22p63s23p64s1
⇒ K thuộc chu kì 4; nhóm IA
Cl có cấu hình electron là: 1s22s22p63s23p5
⇒ Cl thuộc chu kì 3; nhóm VIIA

CaCl2 hoặc K2S
Giải thích các bước giải:
X được tạo nên từ hạt Aa+Aa+ có cầu hình e là 1s22s22p63s23p61s22s22p63s23p6
→ A có (18+a) electron
X được tạo nên từ hạt Bb−Bb− có cầu hình e là 1s22s22p63s23p61s22s22p63s23p6
→ B có (18-b) electron
X có dạng AbBaAbBa
Gọi số hạt proton, notron trong A, B lần lượt là pA, pB, nA, nB
Số p = Số e
Tổng số hạt trong X là: b(2pA+nA) + a.(2pB+nB) = 164
p≤n≤1,52p
→ b. 3pA + a . 3pB ≤ 164 ≤ b . 3,52pA + a . 3,52pB
Số e = Số p; a ≥ 1
3b.(18+a)+3a.(18−b)≤164≤3,52b.(18+a)+3,52a.(18−b)→⎧⎪⎨⎪⎩3b.(18+1)<1643b.(18+a)+3a.(18−b)≤164≤3,52b.(18+a)+3,52a.(18−b)→⎧⎪⎨⎪⎩b<2,883b.(18+a)+3a.(18−b)≤164≤3,52b.(18+a)+3,52a.(18−b)3b.(18+a)+3a.(18−b)≤164≤3,52b.(18+a)+3,52a.(18−b)→{3b.(18+1)<1643b.(18+a)+3a.(18−b)≤164≤3,52b.(18+a)+3,52a.(18−b)→{b<2,883b.(18+a)+3a.(18−b)≤164≤3,52b.(18+a)+3,52a.(18−b)
TH1:
⎧⎪⎨⎪⎩b=13b.(18+a)+3a.(18−b)≤164≤3,52b.(18+a)+3,52a.(18−b)→{b=11,59≤a≤2,04→{b=1a=2{b=13b.(18+a)+3a.(18−b)≤164≤3,52b.(18+a)+3,52a.(18−b)→{b=11,59≤a≤2,04→{b=1a=2
→ A có 20 electron → A là canxi
B có 17 electron → B là clo
X: CaCl2
TH2:
⎧⎪⎨⎪⎩b=23b.(18+a)+3a.(18−b)≤164≤3,52b.(18+a)+3,52a.(18−b)→{b=20,59≤a≤1,06→{b=2a=1{b=23b.(18+a)+3a.(18−b)≤164≤3,52b.(18+a)+3,52a.(18−b)→{b=20,59≤a≤1,06→{b=2a=1
→ A có 19 electron → A là Kali
B có 16 electron → B là Lưu huỳnh
X: K2S
Các ion xung quanh cấu hình e \(1s^22s^22p^63s^23p^6\) (tổng e = 18) trên là \(Cl^-;S^{2-};P^{3-};K^+;Ca^{2+}\) . Mỗi ion có từ: 54-63 hạt (xét cả 3 loại p, e và n)
→ Trong A phải có 3 ion: \(\frac{164}{54}\) < số ion < \(\frac{164}{63}\)
Phân tử A có dạng XY2 hoặc X2Y
+ Dạng XY2
→ Ion \(X^{2+}\) có 18 e → \(Ca^{2+}\) (vì nguyên tử Ca có 20 electron) và Ion Y− có 18 electron chính là Cl−(vì nguyên tử Cl có 17 electron)
⇒ XY2 là CaCl2
+ Dạng X2Y
→ Ion \(X^+\) có 18 e →\(K^+\) (vì nguyên tử K có 20 electron) và Ion \(Y^{2-}\) có 18 electron chính là \(S^{2-}\)(vì nguyên tử S có 17electron)
⇒ X2Y là K2S

\(\left\{{}\begin{matrix}2Z_A+N_A=140\\2Z_A=65,714\%.140\end{matrix}\right.\)
=>\(\left\{{}\begin{matrix}Z_A=46\\N_A=48\end{matrix}\right.\)
Hợp chất A tạo thành từ ion M+ và X2-
=> CT A: M2X
\(\left\{{}\begin{matrix}2Z_M+2N_M+Z_X+N_X=46+48\\Z_M+N_M-\left(Z_X+N_X\right)=23\end{matrix}\right.\)
=> \(3Z_M+3N_M=117\)
=> \(Z_M+N_M=39\)
Ta có A\(\approx\) MM
=> M là Kali (Z=19)
Ta có : \(2Z_M+2N_M+Z_X+N_X=94\)
=> \(2.39+Z_X+N_X=94\)
=> \(Z_X+N_X=16\)
=> X là O
=> CT của A : K2O