Khi cho 3,33g 1 kim loại tác dụng với nước thì thấy khối lượng dung dịch sau phản ứn tăng 2,82g.
Xác định kim loại đó.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
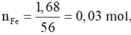
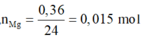
Nếu Fe và Mg phản ứng hết:
![]()
=> mCu = 64.0,045 = 2,88 g > 2,82 g
=> Chứng tò Fe phản ứng còn dư.
![]()
![]()
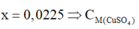
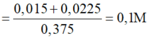

\(n_{FeSO_4}=0.2\cdot1=0.2\left(mol\right)\)
\(2A+nFeSO_4\rightarrow A_2\left(SO_4\right)_n+nFe\)
\(\dfrac{0.4}{n}.........................0.2\)
\(m_{tăng}=m_{Fe}-m_A=0.2\cdot56-\dfrac{0.4}{n}\cdot A=6.4\left(g\right)\)
\(\Rightarrow\dfrac{0.4A}{n}=4.8\)
\(\Rightarrow A=12n\)
\(BL:n=2\Rightarrow A=24\)
\(A:Magie\)

Cho thanh kim loại A(Hóa trị 2) vào dung dịch C u N O 3 2 thấy khối lượng thanh kim loại giảm đi ⇒ M A > M C u ⇔ M A > 64.
Cho thanh kim loại A(Hóa trị 2) vào dung dịch P b N O 3 2 thấy khối lượng thanh kim loại tăng lên ⇒ M A < M P b ⇔ M A < 127 .
⇒ Chọn A.

khối lượng thanh kim loại giảm -> nguyển tử khối của KL phải lớn hơn Cu và đứng trước Cu trong dãy điện hóa
khối lượng thanh kim loại tăng -> nguyển tử khối của KL phải nhỏ hơn Ag
=> KL cần tìm là Zn

Xét 1 mol kim loại ứng với R (gam) tham gia phản ứng.
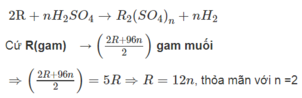
Vậy R=24 (Mg)

bài 2:
gọi oxit kim loại lag A2O3
n H2SO4=0,3.2=0,6mol
PTHH: A2O3+3H2SO4=> A2(SO4)3+3H2O
0,2<- 0,6 ->0,2 ->0,6
M(A2O3)=\(\frac{32}{2.A+16.3}=0,2\)
<=> 0,4A=32-9,6=22,4
<=> A=56
=> CTHH: Fe2O3
m Fe2(SO4)3=0,2.400=80g
Gọi kim loại cần tìm là R
TH1: R + \(H_2O\) →ROH + \(\dfrac{1}{2}H_2\)
0,51 0,255 ( mol)
\(m_{H_2}\) = \(m_{kl}\) - \(m_{ddtăng}\)
⇔ \(m_{H_2}\)= 3,33 - 2,82 = 0,51 (g)
\(n_{H_2}\)= \(\dfrac{m}{M}\) = \(\dfrac{0,51}{2}\)= 0,255 (mol)
\(M_R\) = \(\dfrac{m}{n}\)= \(\dfrac{3,33}{0,51}\) ≃ 7 ( g/ mol) (nhận)
TH2: R + 2\(H_2O\)→ \(ROH_2\)+ \(H_2\)
0,255 0,255 ( mol)
\(m_{H_2}\)= \(m_{kl}\) - \(m_{ddtang}\)
⇔\(m_{H_2}\)= 0,51 (g)
\(n_{H_2}\)= \(\dfrac{m}{M}\)= \(\dfrac{0,51}{2}\)= 0,255 (mol)
\(M_R\)= \(\dfrac{m}{n}\)= \(\dfrac{3,33}{0,255}\) ≃ 13 (g/mol) (loại)
➞Vậy kim loại cần tìm là Liti