Hòa tan hoàn toàn 5.4g kim loại nhôm vào dung dịch H2SO4 thu được Al2(SO4)3
A. Tính TT khí H2 thu được ở đktc
B. Tính KL Al2(SO4)3 tạo thành
C. Tính KL H2SO4 cần dùng bằng 2 cách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTTH: 2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2\(\uparrow\) (1)
Theo pt: 2 ......... 3 ................. 1 ............. 3 ......... (mol)
Theo đề: 0,2 .... 0,3 .............. 0,1 ........... 0,3 ...... (mol)
PTHH: Ba + H2SO4 \(\rightarrow\) BaSO4\(\downarrow\) + H2\(\uparrow\) (2)
Theo pt: 1 ........ 1 ............. 1 ........... 1 ...... (mol)
Theo đề: 0,1 ... 0,1 .......... 0,1 ........ 0,1 ..... (mol)
a) \(n_{H_2}=\dfrac{V_{đktc}}{22,4}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Gọi x (mol) là số mol của H2(1) \(\Rightarrow\) nH2(2) = 0,4 - x (mol)
Do đó: \(n_{Al}=\dfrac{2x}{3}\left(mol\right)\) và \(n_{Ba}=0,4-x\left(mol\right)\)
Ta có: \(m_{Al}+m_{Ba}=19,1\left(gt\right)\) \(\Leftrightarrow27.\dfrac{2x}{3}+137\left(0,4-x\right)=19,1\)
\(\Leftrightarrow18x+54,8-137x=19,1\)
\(\Leftrightarrow18x-137x=19,1-54,8\)
\(\Leftrightarrow-119x=-35,7\)
\(\Leftrightarrow x=0,3\left(mol\right)\)
Suy ra: \(n_{Al}=\dfrac{2x}{3}=\dfrac{2.0,3}{3}=0,2\left(mol\right)\)
và \(n_{Ba}=0,4-x=0,4-0,3=0,1\left(mol\right)\)
\(m_{Al}=n.M=0,2.27=5,4\left(g\right)\)
\(m_{Ba}=n.M=0,1.137=13,7\left(g\right)\)
\(\%m_{Al}=\dfrac{m_{Al}}{m_{hh}}.100\%=\dfrac{5,4}{19,1}.100\%\approx28,27\%\)
\(\%m_{Ba}=\dfrac{m_{Ba}}{m_{hh}}.100\%=\dfrac{13,7}{19,1}.100\%\approx71,73\%\)
b) \(m_{H_2SO_4}=m_{H_2SO_{4\left(1\right)}}+m_{H_2SO_{4\left(2\right)}}=98\left(0,3+0,1\right)=39,2\left(g\right)\)

a) $n_{H_2SO_4} = \dfrac{44,1}{98} = 0,45(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
Theo PTHH :
$n_{Al} = \dfrac{2}{3}n_{H_2SO_4} = 0,3(mol)$
$m_{Al} = 0,3.27 = 8,1(gam)$
b) $n_{H_2} = n_{H_2SO_4} = 0,45(mol)$
$\Rightarrow V_{H_2} = 0,45.22,4 =1 0,08(lít)$
c)
Cách 1 : $n_{Al_2(SO_4)_3} = \dfrac{1}{3}n_{H_2SO_4} = 0,15(mol)$
$\Rightarrow m_{Al_2(SO_4)_3} = 0,15.342 = 51,3(gam)$
Cách 2 : Bảo toàn khối lượng, $m_{Al_2(SO_4)_3} = 8,1 + 44,1 - 0,45.2 = 51,3(gam)$

a, PTHH: Na2CO3 + 2HCL --> 2NaCl + CO2 + H2O.
nNa2CO3 = 10,6 : 106 = 0,1 mol.
theo PTHH:
nCO2 = nNa2CO3 = 0,1 mol.
vCO2 = 0,1 x22,4 = 2,24 l.
b,theo PTHH:
nNaCl = 2nNa2CO3 = 0,2 mol.
mNaCl = 0,2 x 58,5 = 11,7 g.
c,theo PTHH:
nHCL = 2nNa2CO3 = 0,2 mol.
mHCl = 0,2 x 36,5 = 7,3 g.

BaCO3 + H2SO4 -> BaSO4 + CO2 + H2O (1)
CaCO3 + H2SO4 -> CaSO4 + CO2 + H2O (1)
nCO2=0,3(mol)
Đặt nBaCO3=a
nCaCO3=b
Ta có:
\(\left\{{}\begin{matrix}197a+100b=39,7\\a+b=0,3\end{matrix}\right.\)
=>a=0,1;b=0,2
mBaCO3=197.0,1=19,7(g)
mCaCO3=100.0,2=20(g)
%mBaCO3=\(\dfrac{19,7}{39,7}.100\%=49,622\%\)
%mCaCO3=100-49,622=50,378%
d;
Theo PTHH 1 và 2 ta có:
nBaCO3=nH2SO4(1)=0,1(mol)
nCaCO3=nH2SO4(2)=0,2(mol)
mH2SO4=98.0,3=29,4(g)
mdd =29,4:20%=147(g)

a) Zn + 2HCl --> ZnCl2 +H2 (1)
2Al + 6HCl --> 2AlCl3 +3H2 (2)
nH2 = 8,512/22,4=0,38(mol)
=> mH2=0,38 .2=0,76(g)
theo PTHH : nHCl=2nH2=0,76(mol)
=> mHCl=0,76.36,5=27,74(g)
áp dụng định luật bảo toàn khối lượng ta có :
mmuối=16,24+27,74-0,76=43,22(g)
b) giả sử nZn =x(mol)
nAl=y(mol)
=>65x+27y=16,24 (I)
theo (1) : nH2=nZn =x(mol)
theo(2) : nH2 =nAl=y(mol)
=> 2x + 2y=0,76(II)
từ (I) và (II) ta có :
65x+27y=16,24
2x+2y=0,76
=>x=0,15(mol)
y=0,22(mol)
=> mZn =0,15.65=9,75(g)
mAl=16,24 - 9,75=6,49(mol)
=>%mZn=9,75/16,24 .100=60,03%
%mAl=100 - 60,03=39,96%
c) theo pthh : nHCl=nZn,Al=0,15+0,22=0,37(mol)
=>mHCl=0,37.36,5=13,505(g)

Đáp án C
Ta có: nCO = 0,8 mol; = 0,9 mol
Gọi n là hóa trị của kim loại M (1 ≤ n ≤ 3)
Trong phản ứng giữa M với H2SO4 đặc nóng, M là chất khử nhường electron.
H2SO4 đặc là chất oxi hóa nhận electron:

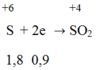
Trong phản ứng khử oxit kim loại bởi CO ta luôn có:
nO (trong oxit) = nCO = 0,8 mol
⇒Tỉ lệ:
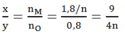
Dựa vào các đáp án ta thấy n = 2 hoặc n = 3


a) Gọi số mol Al, Fe là x, y
mhh = mAl + mFe
→ 27x + 56y = 5,5 (1)
nH2 = 4,48 : 22,4 = 0,2 mol
2Al + 6HCl → 2AlCl3 + 3H2↑
x → 3x → x → \(\frac{3x}{2}\)
Fe + 2HCl → FeCl2 + H2↑
y → 2y → y → y
nH2 =\(\frac{3x}{2}\)+ y = 0,2 (mol) (2)
Từ (1) và (2) → x = 0,1; y = 0,05
\(\%m_{Al}=\frac{0,1.27}{5,5}.100\%=49,09\%\)
\(\%m_{Fe}=100\%-49,09\%=50,91\%\)
b) nHCl p.ứ = 3 . 0,1 + 2 . 0,05 = 0,4 (mol)
mHCl = 0,4 . 36,5 = 14,6 (g)
mdd HCl = 14,6 : 14,6% = 100(g)
mdd sau phản ứng = mKL + mdd HCl - mH2
= 5,5 + 100 - 0,2 . 2
= 105,1 (g)
Sau phản ứng dung dịch có: AlCl3 (0,1 mol); FeCl2 (0,05 mol)
\(C\%_{AlCl3}=\frac{0,1.133,5}{105,1}.100\%=12,7\%\)
\(C\%_{FeCl2}=\frac{0,05.127}{105,1}.100\%=6,04\%\)
PTHH: 2Al + 3H2SO4 \(\rightarrow\)Al2(SO4)3 + 3H2\(\uparrow\)
Theo pt: . 2 ........ 3................... 1............ 3.... (mol)
Theo đề: 0,2 ..... 0,3 ............... 0,1 ........ 0,3... (mol)
a) \(n_{Al}=\dfrac{m}{M}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(V_{H_{2_{đktc}}}=n.22,4=0,3.22,4=6,72\left(l\right)\)
b) \(m_{Al_2\left(SO_4\right)_3}=n.M=0,1.342=34,2\left(g\right)\)
c)
Cách 1:
\(m_{H_2}=n.M=0,3.2=0,6\left(g\right)\)
Theo định luật bảo toàn khối lượng, ta có:
mAl + m H2SO4 = mAl2(SO4)3 + mH2
=> mH2SO4 = mAl2(SO4)3 + mH2 - mAl = 34,2 + 0,6 - 5,4 = 29,4 (g)
Cách 2:
mH2SO4 = n.M = 0,3.98 = 29,4 (g)
Cô bổ sung 1 chút ở cách 2: Nên thêm nH2SO4=nH2=0,3mol