
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

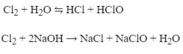

a) PTHH: \(K_2O+H_2O\rightarrow2KOH\)
Ta có: \(n_{KOH}=2n_{K_2O}=2\cdot\dfrac{23,5}{94}=0,5\left(mol\right)\) \(\Rightarrow C_{M_{KOH}}=\dfrac{0,5}{0,5}=1\left(M\right)\)
b) PTHH: \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
Theo PTHH: \(n_{H_2SO_4}=\dfrac{1}{2}n_{KOH}=0,25\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,25\cdot98}{20\%}=122,5\left(g\right)\) \(\Rightarrow V_{ddH_2SO_4}=\dfrac{122,5}{1,14}\approx107,46\left(ml\right)\)
c) Theo PTHH: \(n_{KOH}=0,5\left(mol\right)\) \(\Rightarrow m_{ddKOH}=\dfrac{0,5\cdot56}{5,6\%}=500\left(g\right)\) \(\Rightarrow V_{ddKOH}=\dfrac{500}{1,045}\approx478,47\left(ml\right)\)
Câu 8 :
số mol của kali oxit
nK2O = \(\dfrac{m_{K2O}}{M_{K2O}}=\dfrac{23,5}{94}=0,25\left(mol\right)\)
a) Pt : K2O + H2O → 2KOH\(|\)
1 1 2
0,25 0,5
Số mol của dung dịch kali hdroxit
nKOH = \(\dfrac{0,25.2}{1}=0,5\left(mol\right)\)
Nồng độ mol của dung dịch kali hidroxit
CMKOH = \(\dfrac{n}{V}=\dfrac{0,5}{0,5}=1\left(l\right)\)
b) Pt : H2SO4 + 2KOH → K2SO4 + 2H2O\(|\)
1 2 1 2
0,25 0,5
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{0,25.1}{2}=0,25\left(mol\right)\)
khối lượng của axit sunfuric
mH2SO4 = nH2SO4. MH2SO4
= 0,25 . 98
= 24,5 (g)
Khối lượng của dung dịch axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{24,5.100}{20}=122,5\) (g)
Thể tích của dung dịch của axit sunfuric cần dùng
D = \(\dfrac{m}{V}\Rightarrow V=\dfrac{m}{D}=\dfrac{122,5}{1,14}=107,45\left(ml\right)\)
c) Pt : 2KOH + H2SO4 → K2SO4 + 2H2O\(|\)
2 1 1 2
0,5 0,25
Số mol của kali hidroxit nKOH = \(\dfrac{0,25.2}{1}=0,5\left(mol\right)\)
Khối lượng của kali hidroxit
mKOH = nKOH . MKOH
= 0,5 . 56
= 28 (g)
Khối lượng của dung dịch kali hidroxit
C0/0KOH = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{28.100}{5,6}=500\left(g\right)\)
Thể tích của dung dịch kali hidorxit cần dùng
D = \(\dfrac{m}{V}\Rightarrow V=\dfrac{m}{D}=\dfrac{500}{1,045}=478,47\left(ml\right)\)
Chúc bạn học tốt

A, B, C đều là các hợp chất vô cơ của natri.
dd A + dd B → khí X
dd A + dd C → khí Y
=> A,B, C đều phải là các chất tan được trong nước (tính tan vật lí)
=> A phải có tính axit thì mới tác dụng được với dd B, C để giải phóng ra khí
X, Y đều tác dụng được với dd kiềm => X, Y đều là oxit axit
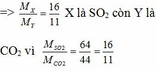
=> A là NaHSO4
B là Na2SO3 hoặc NaHSO3
C là Na2CO3 hoặc NaHCO3
2NaHSO4 + Na2SO3 → 2Na2SO4 + SO2↑ + H2O
NaHSO4 + NaHSO3 → Na2SO4 + SO2↑ + H2O
2NaHSO4 + Na2CO3 → 2Na2SO4 + CO2↑ + H2O
NaHSO4 + NaHCO3 → Na2SO4 + CO2↑ + H2O
SO2, CO2 đều tác dụng được với dung dịch kiềm
Ví dụ:
SO2 + 2NaOH → Na2SO3 +H2O
CO2 + 2NaOH → Na2CO3 + H2O

A là \(P_2O_5\)
\(P_2O_5+3H_2O\to 2H_3PO_4\) làm quỳ hóa đỏ
B là \(Fe\)
\(Fe+2HCl\to FeCl_2+H_2\uparrow\)
D là \(Ba\)
\(Ba+H_2O\to Ba(OH)_2+H_2\uparrow\\ Ba+2HCl\to BaCl_2+H_2\uparrow\)
E là \(BaO\)
\(BaO+H_2O\to Ba(OH)_2\) làm quỳ tím hóa xanh
G là \(Fe_3O_4\text{ hoặc }Fe_2O_3\)
\(Fe_3O_4+4H_2\xrightarrow{t^o}3Fe+4H_2O\\ Fe_2O_3+3H_2\xrightarrow{t^o}2Fe+3H_2O\)

a) Giảm dần : Na Mg Cu Ag Au
b) Tác dụng với nước ở nhiệt độ thường : Na
Pt : \(2Na+2H_2O\rightarrow2NaOH+H_2\)
c) Tác dụng với dung dịch HCl : Na , Mg
Pt : \(2Na+2HCl\rightarrow2NaCl+H_2\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
d) Tác dụng với dung dịch CuSO4 : Mg
Pt : \(Mg+CuSO_4\rightarrow MgSO_4+Cu\)
Chúc bạn học tốt