Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
K2O + H2O → 2KOH
Ta có nK2O = 0,1 mol ⇒ nKOH = 0,2 mol.
⇒ mKOH = 11,2 gam.
⇒ C%KOH = 11 , 2 9 , 4 + 70 , 6 × 100 = 14%.

Chọn đáp án B.
Quy đổi X tương đương với hỗn hợp gồm Na (a mol), K (0,4 mol), O (b mol)


Đáp án A
n(KOH) = 0,4 mol ; n(H2) 0,15 mol
Quy đổi hh X về: K (0,4 mol); Na (x mol); O ( y mol).
Ta có hệ:
23x + 16y + 0,4.39 = 25,7
x + 0,4 = 0,15.2 + 2.y ( bảo toàn e).
Giải hệ: x = 0,3; y = 0,3
Dung dịch Y chứa: KOH (0,4 mol) và NaOH ( 0,3 mol).
→ n(OH-) = 0,7 mol.
Xét n(OH-)/n(H3PO4) = 0,7 : 0,4 = 1,75 nên tạo 2 muối H2PO4- ( a mol) và HPO42- ( b mol)
Có hệ:
a + 2b = 0,7 ( bảo toàn điện tích)
a + b = 0,4 ( bảo toàn nguyên tố P)
Giải hệ: a = 0,1; b = 0,3.
Nên muối gồm: 0,1 mol H2PO43-; 0,3 mol HPO42-; 0,3 mol Na+; 0,4 mol K+.
→ m(muối) = 61 gam.

mkhí = 9; mKCl =59,6
→ nHCl = nKCl = 0,8
→ mdd HCl = 200 ⇒ mdd Y = 237,6g
BTKL: m = mdd Y +m khí - mHCl = 46,6
Đáp án A

Đáp án A
Dung dịch Z làm quỳ tím hóa xanh, chứng tỏ Z chứa ion AlO 2 - . Suy ra dung dịch Y chứa NaCl và NaOH. Sơ đồ phản ứng :
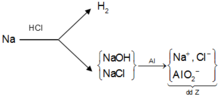
Theo bảo toàn nguyên tố Na, Al và bảo toàn điện tích trong dung dịch Z, ta có:
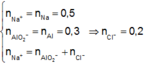
![]()

Đáp án A
Nếu 0,105 mol KOH chuyển hết về 0,105 mol KNO3 thì nhiệt phân thu 0,105 mol KNO3 ứng 8,925 gam.
Theo đó, KOH còn dư sau phản ứng. Giải hệ:
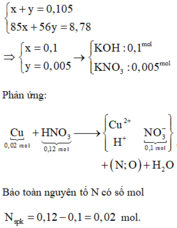
Bảo toàn điện tích → X gồm 0,02 mol Cu(NO3)2 và 0,06 mol HNO3 dư → số mol H2O là 0,03.
Ghép cụm hoặc bảo toàn nguyên tố O có ngay số mol Ospk = 0,03 mol.


Đáp án A
![]()
![]()
Giả sử KOH hết => rắn chứa
![]()
=> trái gt =>KOHdư=>rắn gồm KOH dư và K N O 2 với số mol x và y.
Ta có:
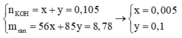
Bảo toàn nguyên tố Nitơ: n N / k h í = 0 , 02 m o l
Bảo toàn điện tích trong X: 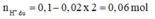
Bảo toàn nguyên tố Hiddro: ![]()
Bảo toàn nguyên tố Oxi: ![]()
Bảo toàn khối lượng: m d d s a u p . ư = 13 , 12 ( g )
![]()
= 28,66%

Đáp án B
Đặt 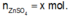
n Zn OH 2 TN 1 n Zn OH 2 TN 2 = m Zn OH 2 TN 1 m Zn OH 2 TN 2 = 3 a 2 a = 3 2 ⇒ n Zn OH 2 TN 1 = 3 y , n Zn OH 2 TN 2 = 2 y
Từ giả thiết, suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Ở TN1 có thể kết tủa đã bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 Zn OH 2 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
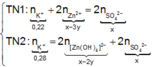
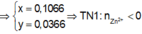 loại
loại
● Nếu ở TN1 Zn OH 2 đã bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
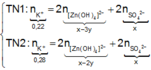
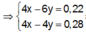
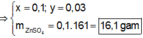

mdung dịch sau phản ứng = 9,4 + 70,6 = 80 gam
C % = 11 , 2 80 . 100 % = 14 %