Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
a, Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{30}{98}=\dfrac{15}{49}\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{2}< \dfrac{\dfrac{15}{49}}{3}\) , ta được H2SO4 dư.
b, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
c, Sau phản ứng, trong cốc có H2SO4 dư và Al2(SO4)3.
Theo PT: \(\left\{{}\begin{matrix}n_{H_2SO_4\left(pư\right)}=\dfrac{3}{2}n_{Al}=0,3\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=\dfrac{15}{49}-0,3\approx0,006\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{H_2SO_4\left(dư\right)}=0,006.98=0,588\left(g\right)\\m_{Al_2\left(SO_4\right)_3}=0,1.342=34,2\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!

nAl=0.2(mol)
nH2SO4=0.4(mol)
2Al+3H2SO4->Al2(SO4)3+3H2
Theo pthh,nH2SO4=3/2 nAl
Theo bài ra,nH2SO4=2nAl
-> H2SO4 dư tính theo Al
nH2SO4 phản ứng:0.2*3/2=0.3(mol)
nH2SO4 dư=0.40.3=0.1(mol)
mH2SO4 dư:0.1*98=9.8(g)
Theo pthh,nH2=3/2 nAl->nH2=0.3(mol)
VH2=0.3*22.4=6.72(l)

`Fe + H_2 SO_4 -> FeSO_4 + H_2`
`0,25` `0,25` `0,25` `(mol)`
`a)n_[Fe]=[22,4]/56=0,4(mol)`
`n_[H_2 SO_4]=[24,5]/98=0,25(mol)`
Có: `[0,4]/1 > [0,25]/1=>Fe` hết, `H_2 SO_4`
`=>m_[Fe(dư)]=(0,4-0,25).56=8,4(g)`
`b)V_[H_2]=0,25.22,4=5,6(l)`
Ko được ghi `Fe+H_2 SO_4->Fe_2 (SO_4)_3+H_2` vì đây là `H_2 SO_4` loãng

\(a,n_{Fe}=\dfrac{22,4}{56}=0,4(mol)\\ n_{H_2SO_4}=\dfrac{24,5}{98}=0,25(mol)\\ Fe+H_2SO_4\to FeSO_4+H_2\\ LTL:\dfrac{0,4}{1}>\dfrac{0,25}{1}\Rightarrow Fe\text{ dư}\\ n_{Fe(dư)}=0,4-0,25=0,15(mol)\\ \Rightarrow m_{Fe(dư)}=0,15.56=8,4(g)\\ \)
\(b,m_{dư}=m_{Fe(dư)}=8,4(g)\\ c,n_{H_2}=0,25(mol)\\ \Rightarrow V_{H_2}=0,25.22,4=5,6(l)\\ d,n_{FeSO_4}=0,25(mol)\\\Rightarrow m_{FeSO_4}=0,25.152=38(g)\)

a) PTHH: NaOH + Al + H2O -> NaAlO2 + 3/2 H2
b) nH2= 0,6(mol)
-> nAl=0,4(mol) => mAl=0,4.27=10,8(g)
c) nAl=0,18((mol); nNaOH=0,2(mol)
PTHH: 0,18/1 < 0,2/1
=> Al hết, NaOH dư, tính theo nAl.
-> nH2= 3/2. 0,18=0,27(mol)
=>V(H2,đktc)=0,27.22,4= 6,048(l)
\(n_{H_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
\(2NaOH+2Al+2H_2O\rightarrow2NaAlO_2+3H_2\)
\(...........0.4.........................0.6\)
\(m_{Al}=0.4\cdot27=10.8\left(g\right)\)
\(n_{Al}=\dfrac{4.86}{27}=0.18\left(mol\right)\)
\(n_{NaOH}=\dfrac{8}{40}=0.2\left(mol\right)\)
\(2NaOH+2Al+2H_2O\rightarrow2NaAlO_2+3H_2\)
\(2.................2\)
\(0.2...............0.18\)
\(LTL:\dfrac{0.2}{2}>\dfrac{0.18}{2}\)
\(\Rightarrow NaOHdư\)
\(n_{H_2}=0.18\cdot\dfrac{3}{2}=0.27\left(mol\right)\)
\(V_{H_2}=0.27\cdot22.4=6.048\left(l\right)\)

PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\\n_{H_2SO_4}=\dfrac{980\cdot10\%}{98}=1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư, Kẽm p/ứ hết
\(\Rightarrow n_{H_2}=0,4\left(mol\right)\) \(\Rightarrow V_{H_2}=0,4\cdot22,4=8,96\left(l\right)\)

\(n_{Al}=\dfrac{2,5}{27}=\dfrac{25}{270}=\dfrac{5}{54}\left(mol\right)\\ n_{H_2SO_4}=0,5\left(mol\right)\\ a,2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ b,Vì:\dfrac{\dfrac{5}{54}}{2}< \dfrac{0,5}{4}\Rightarrow H_2SO_4dư\\ b,n_{H_2SO_4\left(dư\right)}=0,5-\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{13}{36}\left(mol\right)\\ \Rightarrow m_{H_2SO_4}=\dfrac{13}{36}.98=\dfrac{637}{18}\left(g\right)\\ c,n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{5}{36}\left(mol\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=\dfrac{5}{36}.22,4=\dfrac{28}{9}\left(l\right)\)


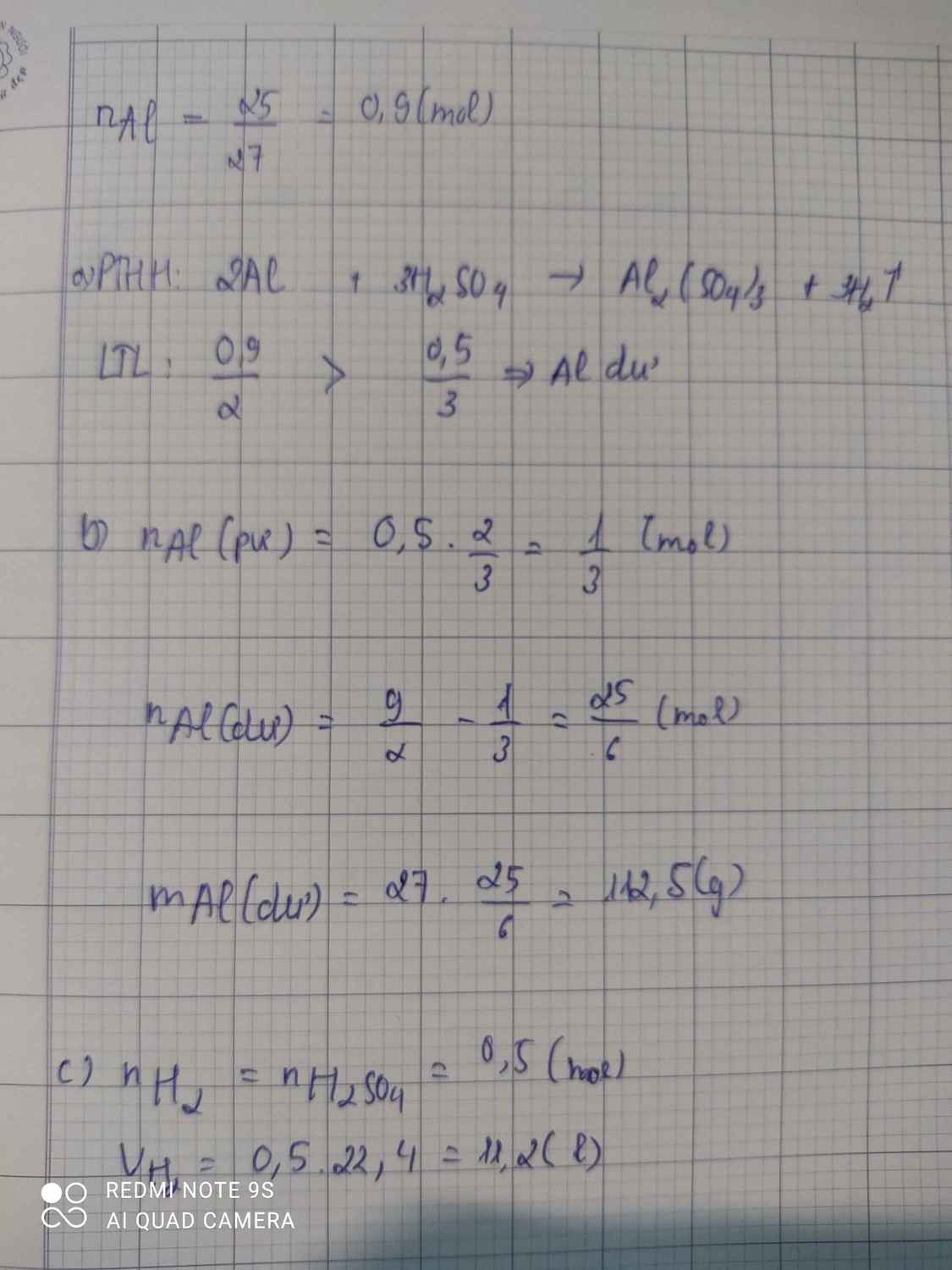
2Al+3H2SO4->Al2(SO4)3+3H2
0,2-----0,3-------0,1------------0,3
n Al=\(\dfrac{5,4}{27}\)=0,2 mol
n H2SO4= \(\dfrac{30}{98}\)=0,306 mol
=>H2SO4 còn dư
=>VH2=0,3.22,4=6,72l
=>m Al2(SO4)3=0,1.342=34,2g
=>m H2SO4 dư=0,006.98=0,588g
\(n_{Al}=\dfrac{m_{Al}}{M_{Al}}=\dfrac{5,4}{27}=0,2mol\)
\(n_{H_2SO_4}=\dfrac{m_{H_2SO_4}}{M_{H_2SO_4}}=\dfrac{30}{98}=\dfrac{15}{49}mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
2 3 1 3 ( mol )
0,2 15/49 ( mol )
Ta có: \(\dfrac{0,2}{2}< \dfrac{15}{49}:3\)
=> Chất còn dư là \(H_2SO_4\)
\(V_{H_2}=n_{H_2}.22,4=\left(\dfrac{0,2.3}{2}\right).22,4=6,72l\)
\(m_{Al_2\left(SO_4\right)_3}=n_{Al_2\left(SO_4\right)_3}.M_{Al_2\left(SO_4\right)_3}=\left(\dfrac{0,2.1}{2}\right).342=34,2g\)
\(m_{H_2SO_4\left(du\right)}=n_{H_2SO_4\left(du\right)}.M_{H_2SO_4}=\left(\dfrac{15}{49}-\dfrac{0,2.3}{2}\right).98=0,6g\)