Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Áp suất sau bằng áp suất trước phản ứng nên số mol khí phản ứng bằng số mol khí tạo thành

Gọi số mol Na, Zn là a, b
=> 23a + 65b = 14,3
n H2=\(\dfrac{2,24}{22,4}\)=0,1 mol
- Nếu Zn tan hết
2Na + 2H2O --> 2NaOH + H2
a-------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
2b<----b-------------------->b
->\(\left\{{}\begin{matrix}2b\text{≤}a\\0,5a+b=14,3\end{matrix}\right.\) loại
=> Zn không tan hết => NaOH hết
PT:2Na + 2H2O --> 2NaOH + H2
a------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
\ a--------------------------->0,5a
=> 0,5a + 0,5a = 0,1
=> a = 0,1
=> mNa = 0,1.23 = 2,3 (g)
=> mZn = 14,3 - 2,3 = 12(g)
PTP. ứng:
Fe+S----> FeS
Fe+ 2HCl--> FeCl2+H2
x x (mol)
FeS+ 2HCl--> FeCl2+ H2S
y y (mol)
Gọi n H2 và H2S trong C lần lượt là x và y mol, ta có hpt:
x+y=0.1
(2x+32y)/2(x+y)=13
--> x=0.02, y=0.08
--> tổng m Fe+n FeS= n Fe tỏng A=x+y=0.1 mol
m Fe=0.1.56=5.6 (g)

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
PTHH: Fe + S --to--> FeS (1)
LTL: \(0,2>0,15\rightarrow\) Fe dư
Theo pthh (1):
\(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,15\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8\left(g\right)\\m_{FeS}=0,15.88=13,2\left(g\right)\end{matrix}\right.\)
PTHH:
FeS + 2HCl ---> FeCl2 + H2S
0,15 0,15
Fe + 2HCl ---> FeCl2 + H2
0,05 0,05
\(\rightarrow M_Z=\dfrac{0,15.34+0,05.2}{0,15+0,05}=26\left(\dfrac{g}{mol}\right)\)
=> dZ/H2 = \(\dfrac{26}{2}=13\)

A + H2SO4 → Hỗn hợp khí ⇒ Fe dư; khí Y gồm: H2 ( x mol) và H2S (y mol)
⇒ x + y = 0,1 mol (1)
Bảo toàn S: nH2S = nFeS = nS = y mol
nFe dư = nH2 = x
Bảo toàn Fe: nFe = nFeS + nFe dư = x + y
mX = 56(x + y ) + 32y = 7,2g (2)
Từ (1)(2) ⇒ x = 0,05 mol; y = 0,05 mol
MY = mY : nY = (0,05.2 + 0,05.34) : 0,1 = 18 ⇒ dY/H2 = 9
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
TH1: S dư
Vậy toàn bộ lượng khí sinh ra là H2S
\(d_{Y\text{/}H_2}=d_{H_2S\text{/}H_2}=\dfrac{34}{2}=17\)
TH2: Fe dư
\(n_{khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Bảo toàn KL: \(m_A=m_X=7,2\left(g\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a----------------------------->a
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
b-------------------------------->b
Ta có hệ phương trình: \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\)
\(\Leftrightarrow a=b=0,05\left(TM\right)\)
\(M_Y=\dfrac{0,05.\left(2+34\right)}{0,1}=18\left(g\text{/}mol\right)\\ \rightarrow d_{Y\text{/}H_2}=\dfrac{18}{2}=9\)

Đặt nZn = x mol; nFe = y mol.
Ta có hệ phương trình: 
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

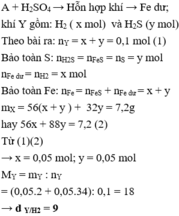
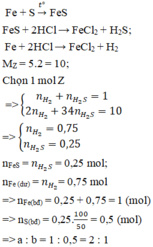
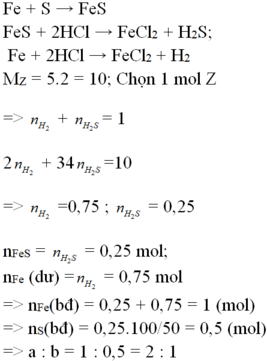
4FeCO3 + O2 ---> 2Fe2O3 + 4CO2
a.................0,25a........................a
4FeS2 +11O2 ---> 2Fe2O3 + 8SO2
b.............11/4b.......................2b
vì áp suất trc và sau pứ = nhau nên V khí trc và sau pứ cx = nhau
-----> 0,25a + 11/4b = a+2b ---> a/b=1
vậy FeS=50%
FeCO3=50%
tỉ lệ số mol 2 FeS2 và FeCO3 thì là 50%:50% nhưng đề hỏi tỉ lệ % khối lượng nha em